Difosforus pentoksida
Difosforus pentoksida (Formula empirikal: P2O5,formula kimia:P4O10), ialah oksida fosforus yang dihasilkan dalam pembakaran fosforus di udara. Ia ialah penyerap air yang kuat, dan mempunyai dehidrasi yang sangat kuat, bahkan asid sulfurik pekat dapat dinyahhidrasi untuk menghasilkan sulfur trioksida. Ia sangat mudah dibasahkan dan pengering kuat. Ia menghasilkan asid metafosforik dengan air sejuk dan asid ortofosforik terutamanya dengan air panas.

| |
| |
| Nama | |
|---|---|
| Nama lain
Fosforus (V) oksida
anhidrat fosforik | |
| Pengecam | |
| |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.013.852 |
PubChem CID
|
|
| Nombor RTECS |
|
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| P4O10 | |
| Jisim molar | 283.889 |
| Rupa bentuk | serbuk putih serap air berbau busuk |
| Ketumpatan | 2.39 g/cm3 |
| Takat lebur | 569 °C |
| Takat didih | 360 °C |
| tindak balas | |
| Tekanan wap | 1 mmHg, 384 °C |
| Bahaya | |
| Bahaya-bahaya utama | sangat serap air |
| NFPA 704 (berlian api) | |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| Rujukan kotak info | |
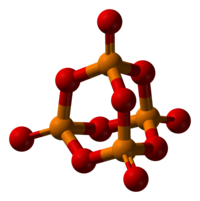
Struktur sunting
Fosforus pentoksida mengkristal dalam sekurang-kurangnya empat bentuk atau polimorf. Yang paling biasa ialah dalam keadaan metastabil,[1] yang ditunjukkan dalam gambar, terdiri daripada molekul P4O10. Daya Van der Waals yang lemah menahan molekul-molekul ini bersama dalam kekisi heksagon (Walau bagaimanapun, walaupun simetri molekulnya tinggi, pembungkusan kristal bukanlah pembungkusan rapat.[2])
Rujukan sunting
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (ed. Kedua). Butterworth-Heinemann. ISBN 978-0-08-037941-8. Cite has empty unknown parameter:
|name-list-format=(bantuan) - ^ Cruickshank, D.W.J. (1964). "Refinements of Structures Containing Bonds between Si, P, S or Cl and O or N: V. P4O10". Acta Crystallogr. 17 (6): 677–9. doi:10.1107/S0365110X64001669.
