Reseptor (biokimia)
Dalam biokimia dan farmakologi, reseptor ialah struktur kimia terdiri daripada protein yang menerima dan memindahkan isyarat yang mungkin disepadukan ke dalam sistem biologi.[1] Isyarat ini biasanya merupakan penghantar kimia[nb 1] yang mengikat kepada reseptor dan menghasilkan tindak balas fisiologi seperti perubahan dalam aktiviti elektrik sel. Sebagai contoh, GABA, neurotransmiter perencatan, menghalang aktiviti elektrik neuron dengan mengikat kepada reseptor GABAA.[2] Ada tiga cara utama tindakan reseptor boleh diklasifikasikan: geganti isyarat, penguatan atau penyepaduan.[3] Penyampaian menghantar isyarat ke hadapan, penguatan meningkatkan kesan ligan tunggal, dan penyepaduan membolehkan isyarat dimasukkan ke dalam laluan biokimia yang lain.[3]
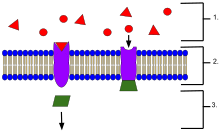
- Ligand di luar sel
- Ligand berhubung dengan protein reseptor khusus berdasarkan bentuk tapak aktif protein.
- Reseptor melepaskan pengutus ketika ligan berhubung dengan reseptor.
Protein reseptor boleh dikelaskan mengikut lokasinya. Reseptor permukaan sel, juga dikenali sebagai reseptor transmembran, termasuk saluran ion berpagaran ligan, reseptor bergandingan protein G dan reseptor hormon berkaitan enzim.[1] Reseptor intrasel ialah yang terdapat di dalam sel, dan termasuk reseptor sitoplasma dan reseptor nukleus.[1] Molekul yang mengikat kepada reseptor dipanggil "ligan" dan boleh menjadi protein, peptida (protein pendek), atau molekul kecil lain, seperti neurotransmiter, hormon, ubat farmaseutikal, toksin, ion kalsium atau bahagian luar virus. atau mikrob. Bahan yang dihasilkan secara endogen yang mengikat kepada reseptor tertentu dirujuk sebagai ligan endogennya. Contohnya ligan endogen untuk reseptor asetilkolina nikotinik ialah asetilkolina, tetapi ia juga boleh diaktifkan oleh nikotin[4][5] dan disekat oleh kurare.[6] Reseptor jenis tertentu dikaitkan dengan laluan biokimia selular tertentu yang sepadan dengan isyarat. Walaupun banyak reseptor ditemui dalam kebanyakan sel, setiap reseptor hanya akan mengikat dengan ligan struktur tertentu. Ini telah dibandingkan dengan cara mangga hanya akan menerima kunci berbentuk khusus. Apabila ligan mengikat kepada reseptor yang sepadan, ia mengaktifkan atau menghalang laluan biokimia berkaitan reseptor, yang mungkin juga sangat khusus.
Protein reseptor juga boleh dikelaskan mengikut sifat ligan. Pengelasan sedemikian termasuk kemoreseptor, mekanoreseptor, reseptor gravitropik, fotoreseptor, magnetoreseptor dan gasoreseptor.
Struktur
suntingStruktur reseptor sangat pelbagai dan termasuk kategori utama berikut, antara lain:
- Jenis 1: Saluran ion berpagaran ligan (reseptor ionotropik) – Reseptor ini biasanya menjadi sasaran neurotransmiter pantas seperti asetilkolina (nikotinik) dan GABA; pengaktifan reseptor ini mengakibatkan perubahan dalam pergerakan ion merentasi membran. Mereka mempunyai struktur heteromer di mana setiap subunit terdiri daripada domain pengikat ligan ekstrasel dan domain transmembran yang merangkumi empat heliks alfa transmembran. Rongga pengikat ligan terletak di antara muka antara subunit.
- Jenis 2: Reseptor bergandingan protein G (reseptor metabotropik) – Ini ialah keluarga terbesar reseptor, dan termasuk reseptor beberapa hormon dan penghantar perlahan seperti dopamina dan glutamat metabotropik. Ia terdiri daripada tujuh heliks alfa transmembran. Gelung yang menghubungkan heliks alfa membentuk domain ekstrasel dan intrasel. Tapak pengikatan untuk ligan peptida yang lebih besar biasanya terletak dalam domain ekstrasel manakala tapak pengikatan ligan bukan peptida yang lebih kecil selalunya terletak di antara tujuh heliks alfa dan satu gelung ekstrasel.[7] Reseptor yang disebutkan di atas digabungkan dengan sistem efektor intraselular yang berbeza melalui protein G.[8] Protein G ialah heterotrimer yang terdiri daripada 3 subunit: α (alfa), β (beta) dan γ (gama). Dalam keadaan tidak aktif, tiga subunit bersekutu bersama dan subunit α mengikat guanosina difosfat (GDP).[9] Pengaktifan protein G menyebabkan perubahan konformasi yang membawa kepada pertukaran GDP menjadi bentuk trifosfat, GTP. Pengikatan GTP kepada subunit α menyebabkan pemisahan subunit β dan γ.[10] Tambahan pula, tiga subunit, α, β dan γ, mempunyai tambahan empat kelas utama berdasarkan jujukan utamanya. Ini termasuk Gs, Gi, Gq dan G12.[11]
- Jenis 3: Reseptor berkaitan kinase dan berkaitan ("kinase tirosina reseptor" dan "reseptor berhubungan enzim") – Ia terdiri daripada domain ekstrasel yang mengandungi tapak pengikat ligan dan domain intrasel, selalunya dengan fungsi enzim, dipautkan oleh heliks alfa transmembran tunggal. Reseptor insulin ialah satu contoh.
- Jenis 4: Reseptor nukleus - Walaupun ia dipanggil sebagai reseptor nukleus, ia sebenarnya terletak di dalam sitoplasma dan berhijrah ke nukleus selepas mengikat dengan ligannya. Ia terdiri daripada rantau pengikat ligan terminal C, domain pengikat DNA teras (DBD) dan domain terminal N yang mengandungi rantau AF1 (fungsi pengaktifan 1). Rantau teras mempunyai dua jejari zink yang bertanggungjawab untuk mengenali jujukan DNA khusus bagi reseptor ini. Terminal N berinteraksi dengan faktor transkripsi sel lain dalam cara bebas ligan; dan bergantung pada interaksi ini, ia boleh mengubah suai pengikatan/aktiviti reseptor. Reseptor steroid dan tiroid-hormon ialah contoh reseptor tersebut.[12]
Reseptor membran boleh diasingkan daripada membran sel melalui prosedur pengekstrakan kompleks menggunakan pelarut, detergen dan/atau penulenan afiniti.
Struktur dan tindakan reseptor boleh dikaji dengan menggunakan kaedah biofizik seperti kristalografi sinar-X, NMR, dikroisme bulat, dan interferometri dwipengkutuban. Simulasi komputer kelakuan dinamik reseptor telah digunakan untuk mendapatkan pemahaman tentang mekanisme tindakan mereka.
Pengikatan dan pengaktifan
suntingPengikatan ligan adalah proses keseimbangan. Ligan mengikat kepada reseptor dan berpisah daripadanya mengikut hukum tindakan jisim dalam persamaan berikut, untuk ligan L dan reseptor, R. Tanda kurung di sekeliling spesies kimia menunjukkan kepekatannya.
Satu ukuran sejauh mana molekul sesuai dengan reseptor ialah pertalian pengikatannya, yang berkait songsang dengan pemalar pemisahan Kd. Kesesuaian yang baik sepadan dengan pertalian tinggi dan Kd rendah. Tindak balas biologi terakhir (contohnya lata pengutus kedua, pengecutan otot), hanya dicapai selepas sejumlah besar reseptor diaktifkan.
Afiniti ialah ukuran kecenderungan ligan untuk mengikat kepada reseptornya. Keberkesanan ialah ukuran ligan terikat untuk mengaktifkan reseptornya.
Agonis berbanding antagonis
suntingTidak setiap ligan yang mengikat kepada reseptor juga mengaktifkan reseptor tersebut. Kelas ligan berikut wujud:
- Agonis (penuh) dapat mengaktifkan reseptor dan menghasilkan tindak balas biologi yang kuat. Ligan endogen semula jadi dengan keberkesanan yang paling besar terhadap reseptor tertentu ialah definisi agonis penuh (keberkesanan 100%).
- Agonis separa tidak mengaktifkan reseptor dengan keberkesanan maksimum walaupun dengan pengikatan maksimum, menyebabkan tindak balas separa berbanding agonis penuh (keberkesanan antara 0 dan 100%).
- Antagonis mengikat kepada reseptor tetapi tidak mengaktifkannya. Ini mengakibatkan sekatan reseptor, menghalang pengikatan agonis dan agonis songsang. Antagonis reseptor boleh bersaing (atau berbalik), dan bersaing dengan agonis untuk reseptor, atau mereka boleh menjadi antagonis tidak boleh balik yang membentuk ikatan kovalen (atau ikatan bukan kovalen pertalian yang sangat tinggi) dengan reseptor dan menyekatnya sepenuhnya. Omeprazola perencat pam proton ialah contoh antagonis yang tidak dapat dipulihkan. Kesan antagonisme tidak dapat dipulihkan hanya boleh diterbalikkan dengan sintesis reseptor baru.
- Agonis songsang mengurangkan aktiviti reseptor dengan menghalang aktiviti konstitutifnya (keberkesanan negatif).
- Modulator alosterik: Ia tidak mengikat pada tapak pengikat agonis reseptor tetapi sebaliknya pada tapak pengikat alosterik tertentu, yang melaluinya ia mengubah suai kesan agonis. Sebagai contoh, benzodiazepina (BZD) mengikat tapak BZD di reseptor GABAA dan mengupayakan kesan GABA endogen.
Ambil perhatian bahawa idea agonisme dan antagonisme reseptor hanya merujuk kepada interaksi antara reseptor dan ligan dan bukan kepada kesan biologinya.
Aktiviti konstitutif
suntingReseptor yang mampu menghasilkan tindak balas biologi tanpa ketiadaan ligan terikat dikatakan memaparkan "aktiviti konstitutif".[13] Aktiviti konstitutif reseptor mungkin disekat oleh agonis songsang. Ubat antiobesiti rimonaban dan taranaban ialah agonis songsang di reseptor CB1 kanabinoid, dan walaupun ia menghasilkan penurunan berat badan yang ketara, kedua-duanya telah ditarik balik oleh kerana terbitan kes kemurungan dan keresahan yang tinggi yang dipercayai berkaitan dengan perencatan aktiviti konstitutif reseptor kanabinoid.
Reseptor GABAA mempunyai aktiviti konstitutif, dan mengalirkan sedikit arus basal tanpa kehadiran agonis. Ini membolehkan beta karbolina bertindak sebagai agonis songsang dan mengurangkan arus di bawah paras basal.
Mutasi di reseptor yang mengakibatkan peningkatan aktiviti konstitutif mendasari beberapa penyakit pewarisan, seperti akil baligh pramatang (disebabkan oleh mutasi pada reseptor hormon peluteinan) dan hipertiroidisme (disebabkan oleh mutasi pada reseptor hormon perangsang tiroid).
Teori interaksi ubat-reseptor
suntingPendudukan
suntingBentuk awal teori reseptor farmakologi menyatakan bahawa kesan ubat adalah berkadar terus dengan bilangan reseptor yang diduduki.[14] Tambahan pula, kesan dadah terhenti apabila kompleks reseptor dadah berpisah.
Ariëns & Stephenson memperkenalkan istilah "afiniti" & "keberkesanan" untuk menerangkan tindakan ligan yang terikat pada reseptor.[15][16]
- Afiniti: Keupayaan ubat untuk bergabung dengan reseptor untuk mencipta kompleks reseptor ubat.
- Keberkesanan: Keupayaan ubat untuk memulakan tindak balas selepas pembentukan kompleks reseptor ubat.
Perkadaran
suntingBerbeza dengan teori pendudukan, teori perkadaran mencadangkan bahawa pengaktifan reseptor adalah berkadar terus dengan jumlah bilangan pertemuan ubat dengan reseptornya setiap unit masa. Aktiviti farmakologi adalah berkadar terus dengan kadar penceraian dan perkaitan, bukan bilangan reseptor yang diduduki:[17]
- Agonis: Ubat dengan perkaitan dan penceraian yang cepat.
- Agonis separa: Ubat dengan perkaitan dan penceraian sederhana.
- Antagonis: Ubat dengan perkaitan, tetapi dengan pemisahan perlahan
Muatan cetusan
suntingApabila ubat menghampiri reseptor, reseptor mengubah bentuk tapak pengikatnya untuk menghasilkan kompleks reseptor dadah.
Reseptor gantian
suntingDalam sesetengah sistem reseptor (cth., asetilkolina di persimpangan saraf-otot dalam otot licin), agonis dapat menimbulkan tindak balas maksimum pada tahap pendudukan reseptor yang sangat rendah (<1%). Oleh itu, sistem itu mempunyai reseptor ganti atau rizab reseptor. Susunan ini menghasilkan ekonomi pengeluaran dan pelepasan neurotransmiter.[12]
Kawal atur reseptor
suntingSel boleh meningkatkan atau mengurangkan bilangan reseptor kepada hormon atau neurotransmiter tertentu untuk mengubah kepekaan mereka kepada molekul yang berbeza. Ini ialah mekanisme maklum balas yang bertindak di tahap tempatan.
- Perubahan dalam konformasi reseptor supaya pengikatan agonis tidak mengaktifkan reseptor. Ini dilihat dengan reseptor saluran ion.
- Penyahgandingan molekul efektor reseptor dilihat dengan reseptor bergandingan protein G.
- Penyerapan reseptor (pemasukan),[18] seperti dalam kes reseptor hormon.
Contoh dan ligan
suntingLigan terhadap reseptor adalah pelbagai seperti reseptornya. GPCR (7TM) ialah keluarga yang sangat besar, dengan sekurang-kurangnya 810 ahli. Terdapat juga LGIC bagi sekurang-kurangnya sedozen ligan endogen, dan banyak lagi reseptor mungkin melalui komposisi subunit yang berbeza. Beberapa contoh umum ligan dan reseptor termasuk:[19]
Saluran ion dan reseptor bergandingan protein G
suntingBeberapa contoh reseptor ionotropik (LGIC) dan metabotropik (khususnya, GPCR) ditunjukkan dalam jadual di bawah. Neurotransmiter utama ialah glutamat dan GABA; neurotransmiter lain ialah neuromodulator. Senarai ini sama sekali tidak lengkap.
| Ligan endogen | Reseptor saluran ion (LGIC) | Reseptor berganding protein G (GPCR) | ||||
|---|---|---|---|---|---|---|
| Reseptor | Arus ion [nb 2] | Ligan eksogen | Reseptor | Protein G | Ligan eksogen | |
| Glutamat | iGluR : NMDA , AMPA, dan reseptor kainat |
Na+, K+, Ca2+[19] | Ketamin | Reseptor glutamat: mGluR | Gq atau Gi/o | - |
| GABA | GABAA
(termasuk GABAA-ro) |
Cl− > HCO−3[19] | Benzodiazepina | Reseptor GABAB | Gi/o | Baklofen |
| Asetilkolina | nAChR | Na+, K+, Ca2+[19] | Nikotin | mAChR | Gq atau Gi | Muskarina |
| Glisina | Reseptor glisina (GlyR) | Cl− > HCO−3[19] | Striknina | - | - | - |
| Serotonin | Reseptor 5-HT3 | Na+, K+[19] | Sereulida | 5-HT1-2 atau 4-7 | Gs, Gi/o atau Gq | - |
| ATP | Reseptor P2X | Ca2+, Na+, Mg2+[19] | BzATP | Reseptor P2Y | Gs, Gi/o atau Gq | - |
| Dopamina | Tiada saluran ion | - | - | Reseptor dopamina | Gs atau Gi/o | - |
Reseptor berhubungan enzim
suntingReseptor yang dikaitkan dengan enzim termasuk kinase tirosina reseptor (RTK), kinase protein spesifik serina/treonina, seperti dalam protein morfogenetik tulang dan guanilat siklase seperti dalam reseptor faktor natriuretik atrium. Daripada RTK, 20 kelas telah dikenal pasti, dengan 58 RTK berbeza sebagai ahli. Beberapa contoh ditunjukkan di bawah:
| Kelas RTK/Keluarga reseptor | Ahli | Ligan endogen | Ligan eksogen |
|---|---|---|---|
| I | EGFR | EGF | Gefitinib |
| II | Reseptor insulin | Insulin | Ketokromin |
| IV | VEGFR | VEGF | Lenvatinib |
Reseptor intrasel
suntingReseptor boleh dikelaskan berdasarkan mekanismenya atau kedudukannya di dalam sel. Empat contoh LGIC intrasel ditunjukkan di bawah:
| Reseptor | Ligan | Arus ion |
|---|---|---|
| Saluran ion berpagaran nukleotida siklik | cGMP (penglihatan), cAMP dan cGTP (pembauan) | Na+, K+[19] |
| Reseptor IP3 | IP3 | Ca2+[19] |
| Reseptor ATP intrasel | ATP (menutup saluran)[19] | K+[19] |
| Reseptor rianodina | Ca2+ | Ca2+[19] |
Peranan dalam kesihatan dan penyakit
suntingDalam gangguan genetik
suntingBanyak gangguan genetik melibatkan kecacatan keturunan dalam gen reseptor. Selalunya, sukar untuk menentukan sama ada reseptor tidak berfungsi atau hormon dihasilkan pada tahap menurun; ini menimbulkan kumpulan "pseudohipo-" gangguan endokrin, di mana nampaknya terdapat penurunan tahap hormon sedangkan sebenarnya reseptor yang tidak bertindak balas dengan secukupnya kepada hormon.
Dalam sistem imun
suntingReseptor utama dalam sistem imun ialah reseptor pengecaman corak (PRR), reseptor seperti tol (TLR), reseptor diaktifkan pembunuh dan perencat pembunuh (KAR dan KIR), reseptor pelengkap, reseptor Fc, reseptor sel B dan reseptor sel T.[20]
Nota
suntingRujukan
sunting- ^ a b c Guyton, Arthur C.; Hall, John E. (2016). Guyton and Hall Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders. m/s. 930–937. ISBN 9781455770052. OCLC 1027900365.
- ^ Mihic, S. John; Harris, R. Adron (1997). "GABA and the GABAA Receptor". Alcohol Health and Research World. 21 (2): 127–131. ISSN 0090-838X. PMC 6826832. PMID 15704348.
- ^ a b Alberts B, Bray D, Hopkin K, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014). Essential Cell Biology (ed. Fourth). New York, NY, USA: Garland Science. m/s. 534. ISBN 978-0-8153-4454-4.
- ^ Gotti, Cecilia; Marks, Michael. J.; Millar, Neil S.; Wonnacott, Susan (16 September 2019). "Nicotinic acetylcholine receptors (version 2019.4)". IUPHAR/BPS Guide to Pharmacology CITE. 2019 (4). doi:10.2218/gtopdb/F76/2019.4. Dicapai pada 17 November 2020.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 9: Autonomic Nervous System". Dalam Sydor A, Brown RY (penyunting). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (ed. 2nd). New York: McGraw-Hill Medical. m/s. 234. ISBN 9780071481274.
Nicotine ... is a natural alkaloid of the tobacco plant. Lobeline is a natural alkaloid of Indian tobacco. Both drugs are agonists [of] nicotinic cholinergic receptors ...
- ^ "Curare Drug Information, Professional". Drugs.com (dalam bahasa Inggeris). Dicapai pada 8 December 2020.
- ^ "The impact of GPCR structures on pharmacology and structure-based drug design". British Journal of Pharmacology. 159 (5): 986–96. March 2010. doi:10.1111/j.1476-5381.2009.00476.x. PMC 2839258. PMID 19912230.
- ^ "Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers". Nature Chemical Biology. 7 (10): 740–7. August 2011. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
- ^ Zubay, Geoffrey (1998). Biochemistry 4th Ed. Dubuque, IA: William C Brown Pub. m/s. 684. ISBN 0697219003.
- ^ Garrett, Reginald; Grisham, Charles (2012). Biochemistry. Cengage Learning. m/s. 1130. ISBN 9781473733602.
- ^ Hamm, Heidi E.; Oldham, William M. (2008). "Heterotrimeric G Protein Activation by G-Protein-Coupled Receptors". Nature Reviews Molecular Cell Biology. Nature Publishing Group. 9 (1): 60–71. doi:10.1038/nrm2299. PMID 18043707.
- ^ a b Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). Rang & Dale's Pharmacology (ed. 7th). Elsevier Churchill Livingstone. ISBN 978-0-7020-3471-8.
- ^ "Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective". Molecular Pharmacology. 64 (6): 1271–6. December 2003. doi:10.1124/mol.64.6.1271. PMID 14645655.
- ^ Rang, HP (January 2006). "The receptor concept: pharmacology's big idea". British Journal of Pharmacology. 147 (Suppl 1): S9-16. doi:10.1038/sj.bjp.0706457. PMC 1760743. PMID 16402126.
- ^ "Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory". Archives Internationales de Pharmacodynamie et de Therapie. 99 (1): 32–49. September 1954. PMID 13229418.
- ^ "A modification of receptor theory". British Journal of Pharmacology and Chemotherapy. 11 (4): 379–93. December 1956. doi:10.1111/j.1476-5381.1956.tb00006.x. PMC 1510558. PMID 13383117.
- ^ Silverman RB (2004). "3.2.C Theories for Drug—Receptor Interactions". The Organic Chemistry of Drug Design and Drug Action (ed. 2nd). Amsterdam: Elsevier Academic Press. ISBN 0-12-643732-7.
- ^ "Short-term desensitization of the angiotensin II receptor of bovinde adrenal glomerulosa cells corresponds to a shift from a high to low affinity state". Endocrinology. 135 (5): 2130–6. November 1994. doi:10.1210/en.135.5.2130. PMID 7956936.
- ^ a b c d e f g h i j k l Boulpaep EL, Boron WF (2005). Medical Physiology: A Cellular and Molecular Approach. St. Louis, Mo: Elsevier Saunders. m/s. 90. ISBN 1-4160-2328-3.
- ^ Waltenbaugh C, Doan T, Melvold R, Viselli S (2008). Immunology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. m/s. 20. ISBN 978-0-7817-9543-2.