Histon
Dalam biologi, histon ialah protein yang sangat bersifat bes dengan banyak lisina dan arginina yang terdapat dalam nukleus sel eukariot dan dalam kebanyakan filum arkea. Ia bertindak sebagai gelendong di mana DNA berpilin untuk mencipta unit struktur yang dipanggil nukleosom.[1][2] Nukleosom pula dibalut menjadi gentian 30 nanometer yang membentuk kromatin padat. Histon menghalang DNA daripada menjadi kusut dan melindunginya daripada kerosakan DNA. Di samping itu, histon memainkan peranan penting dalam pengawalan gen dan replikasi DNA. Tanpa histon, DNA yang tidak dipilin dalam kromosom akan membentang dengan sangat panjang. Sebagai contoh, setiap sel manusia mempunyai kira-kira 1.8 meter DNA jika diregangkan sepenuhnya; walau bagaimanapun, apabila mengelilingi histon, panjang ini dikurangkan kepada kira-kira 90 mikrometer (0.09 mm) gentian kromatin berdiameter 30 nm.[3]
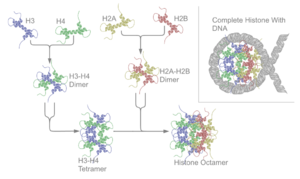
Terdapat lima keluarga histon yang ditetapkan H1/H5 (histon penghubung), H2, H3, dan H4 (histon teras). Teras nukleosom terbentuk daripada dua dimer H2A-H2B dan tetramer H3-H4. Pembalutan DNA yang ketat di sekeliling histon adalah sebahagian besarnya hasil daripada tarikan elektrostatik antara histon bercas positif dan tulang belakang fosfat bercas negatif DNA.
Histon boleh diubah suai secara kimia melalui tindakan enzim untuk mengawal transkripsi gen. Pengubahsuaian yang paling biasa ialah pemetilan bahagian arginina atau lisina, dan pengasetilan lisina. Pemetilan boleh memberi kesan terhadap cara protein lain seperti faktor transkripsi berinteraksi dengan nukleosom. Asetilasi lisina menghapuskan cas positif pada lisina lalu melemahkan daya tarikan elektrostatik antara histon dan DNA, mengakibatkan pelepasan separa DNA, dan menjadikannya lebih mudah diakses bagi tujuan ekspresi gen.
Kelas dan varian sunting
Lima keluarga utama protein histon wujud: H1/H5, H2A, H2B, H3 dan H4.[2][4][5][6] Histon H2A, H2B, H3 dan H4 dikenali sebagai histon teras atau nukleosom, manakala histon H1/H5 dikenali sebagai histon penghubung.
Histon teras semuanya wujud sebagai dimer, yang serupa dengna kesemuanya mempunyai domain lipatan histon: tiga heliks alfa yang dipautkan oleh dua gelung. Struktur heliks inilah yang membolehkan interaksi antara dimer yang berbeza, terutamanya dalam gaya kepala-ekor (juga dipanggil motif jabat tangan).[7] Empat dimer berbeza yang terhasil kemudiannya disatukan untuk membentuk satu teras nukleosom oktamer, dengan diameter kira-kira 63 Angstrom (zarah seperti solenoid). Sekitar 146 pasangan bes (bp) DNA membalut zarah teras ini sebanyak 1.65 kali dalam pusingan super heliks tangan kiri untuk memberikan zarah sekitar 100 Angstrom.[8] Histon penghubung H1 mengikat nukleosom di tapak masuk dan keluar DNA, dengan itu mengunci DNA pada tempatnya,[9] dan membenarkan pembentukan struktur darjat lebih tinggi. Pembentukan yang paling asas ialah gentian 10 nm atau manik dalam konformasi tali. Ini melibatkan pembungkusan DNA di sekeliling nukleosom dengan kira-kira 50 pasangan bes DNA yang memisahkan setiap pasangan nukleosom (juga dirujuk sebagai DNA penghubung). Struktur darjat tinggi termasuk gentian 30 nm (membentuk zigzag yang tidak teratur) dan 100 nm, ini merupakan struktur yang terdapat dalam sel normal. Semasa mitosis dan meiosis, kromosom terkondensasi dipasang melalui interaksi antara nukleosom dan protein pengawalseliaan lain.
Histones dibahagikan kepada histon yang bergantung kepada replikasi kanonik, di mana gennya dinyatakan semasa fasa S kitaran sel, dan varian histon bebas replikasi yang diekspresikan semasa keseluruhan kitaran sel. Dalam mamalia, gen pengekod histon kanonik biasanya dikelompokkan di sepanjang kromosom dalam 4 lokus yang sangat terpelihara, tidak ada intron, dan menggunakan struktur gelung batang di hujung 3' dan bukannya ekor poli(A). Gen pengekod varian histon biasanya tidak berkelompok, berintron, dan mRNA-nya dikawal dengan ekor poli(A).[10] Organisma multisel yang kompleks biasanya mempunyai bilangan varian histon yang lebih tinggi yang menyediakan pelbagai fungsi yang berbeza. Data terkini terkumpul tentang peranan varian histon pelbagai yang menonjolkan hubungan fungsi antara varian dan peraturan halus pembangunan organisma.[11] Protein varian histon daripada organisma berbeza, klasifikasi dan ciri khusus variannya boleh didapati dalam pangkalan data "HistoneDB 2.0 - Variants".[12][13] Beberapa pseudogen juga telah ditemui dan dikenal pasti dalam urutan yang sangat rapat bagi gen ortolog berfungsi masing-masing.[14][15]
Berikut ialah senarai protein histon manusia, gen dan pseudogen:[10]
| Superkeluarga | Keluarga | Gen bergantungan replikasi | Gen bebas replikasi | Pseudogen |
|---|---|---|---|---|
| Penyambung | H1 | H1-1, H1-2, H1-3, H1-4, H1-5, H1-6 | H1-0, H1-7, H1-8, H1-10 | H1-9P, H1-12P |
| Teras | H2A | H2AC1, H2AC4, H2AC6, H2AC7, H2AC8, H2AC11, H2AC12, H2AC13, H2AC14, H2AC15, H2AC16, H2AC17, H2AC18, H2AC19, H2AC20, H2AC21, H2AC25 | H2AZ1, H2AZ2, MACROH2A1, MACROH2A2, H2AX, H2AJ, H2AB1, H2AB2, H2AB3, H2AP, H2AL1Q, H2AL3 | H2AC2P, H2AC3P, H2AC5P, H2AC9P, H2AC10P, H2AQ1P, H2AL1MP |
| H2B | H2BC1, H2BC3, H2BC4, H2BC5, H2BC6, H2BC7, H2BC8, H2BC9, H2BC10, H2BC11, H2BC12, H2BC13, H2BC14, H2BC15, H2BC17, H2BC18, H2BC21, H2BC26, H2BC12L | H2BK1, H2BW1, H2BW2, H2BW3P, H2BN1 | H2BC2P, H2BC16P, H2BC19P, H2BC20P, H2BC27P, H2BL1P, H2BW3P, H2BW4P | |
| H3 | H3C1, H3C2, H3C3, H3C4, H3C6, H3C7, H3C8, H3C10, H3C11, H3C12, H3C13, H3C14, H3C15, H3-4 | H3-3A, H3-3B, H3-5, H3-7, H3Y1, H3Y2, CENPA | H3C5P, H3C9P, H3P16, H3P44 | |
| H4 | H4C1, H4C2, H4C3, H4C4, H4C5, H4C6, H4C7, H4C8, H4C9, H4C11, H4C12, H4C13, H4C14, H4C15 | H4C16 | H4C10P |
Struktur sunting
Teras nukleosom terbentuk daripada dua dimer H2A-H2B dan tetramer H3-H4, membentuk dua bahagian hampir simetri oleh struktur tertier (simetri C2; satu makromolekul ialah imej cermin yang lain).[8] Dimer H2A-H2B dan tetramer H3-H4 juga menunjukkan simetri pseudodiad. 4 histon "teras" (H2A, H2B, H3 dan H4) mempunyai struktur yang agak serupa dan sangat dipelihara sepanjang evolusi, semuanya menampilkan motif heliks-pusing-heliks-pusing-heliks (motif protein pengikat DNA yang mengenali urutan DNA tertentu). Mereka juga berkongsi ciri "ekor" panjang pada satu hujung struktur asid amino - ini merupakan lokasi pengubahsuaian selepas terjemahan (lihat di bawah).[16]
Histone arkea hanya mengandungi struktur dimer seperti H3-H4 yang diperbuat daripada satu jenis unit. Struktur dimerik sedemikian boleh disusun menjadi superheliks yang tinggi ("hipernukleosom") di mana DNA bergelung dengan cara yang serupa dengan gelendong nukleosom.[17] Hanya beberapa histon arkea mempunyai ekor.[18]
Jarak antara gelendong di sekeliling sel eukariot menggulung DNA mereka telah ditentukan untuk berpilin antara 59 hingga 70 Å.[19]
Secara keseluruhannya, histon membuat lima jenis interaksi dengan DNA:
- Jambatan garam dan ikatan hidrogen antara rantai sampingan asid amino bes (terutamanya lisina dan arginina), dan oksigen fosfat pada DNA
- Dwikutub heliks membentuk alfa-heliks dalam H2B, H3 dan H4, menyebabkan cas positif bersih terkumpul pada titik interaksi dengan kumpulan fosfat bercas negatif pada DNA
- Ikatan hidrogen antara tulang belakang DNA dan kumpulan amida pada rantai utama protein histon
- Interaksi bukan berkutub antara histon dan gula deoksiribosa pada DNA
- Sisipan alur kecil tidak khusus bagi ekor terminal H3 dan H2B N ke dalam dua alur kecil setiap satu pada molekul DNA
Sifat histon yang sangat asas, selain daripada memudahkan interaksi DNA-histone, menyumbang kepada keterlarutan airnya.
Histones tertakluk kepada pengubahsuaian pascaterjemahan oleh enzim, terutamanya di ekor terminal N, tetapi juga dalam domain globular.[20][21] Pengubahsuaian sedemikian termasuk pemetilan, pensitrulinaan, pengasetilan, pemfosforilan, pen-SUMO-an, pengubikuitinan dan ADP-peribosilan. Ini member kesan terhadap fungsi peraturan gen mereka.
Secara umum, gen yang aktif kurang terikat terhadap histon, manakala gen yang tidak aktif sangat terikat dengan histon semasa interfasa.[22] Nampaknya juga struktur histon telah dipelihara secara evolusi, kerana sebarang mutasi yang merosakkan akan menjadi masalah yang teruk. Semua histon mempunyai terminal N bercas sangat positif dengan banyak sisa lisina dan arginina.
Evolusi dan taburan spesies sunting
Histon teras ditemui dalam nukleus sel eukariot dan kebanyakan filum arkea, tetapi tidak dalam bakteria.[18] Alga unisel yang dikenali sebagai dinoflagelat sebelum ini dianggap sebagai satu-satunya eukariot yang tiada histon langsung,[23] tetapi kajian terkemudian menunjukkan bahawa DNA mereka masih mengekod gen histon.[24] Tidak seperti histon teras, homolog protein histon penghubung (H1) kaya lisina ditemui dalam bakteria, atau dikenali sebagai nukleoprotein HC1/HC2.[25]
Telah dicadangkan bahawa protein histon teras secara evolusi berkaitan dengan bahagian heliks domain AAA+ ATPase dilanjutkan, domain C, dan domain pengiktirafan substrat terminal N protein Clp/Hsp100. Walaupun terdapat perbezaan dalam topologi mereka, ketiga-tiga lipatan ini berkongsi motif heliks-untaian-hekils (HSH) homolog.[16] Ia juga dicadangkan bahawa ia mungkin telah berkembang daripada protein ribosom (RPS6 / RPS15), kedua-duanya adalah protein pendek dan bes.[26]
Histon arkea mungkin menyerupai pelopor evolusi kepada histon eukariot.[18] Protein histon adalah antara protein-protein yang paling terpelihara dalam eukariot, dengan itu menekankan peranan pentingnya dalam biologi nukleus.[2]:939 Sebaliknya, sel sperma matang sebahagian besarnya menggunakan protamina untuk membungkus DNA genomik mereka, kemungkinan besar kerana ini membolehkannya mencapai nisbah pembungkusan yang lebih tinggi.[27]
Terdapat beberapa bentuk varian dalam beberapa kelas utama. Ia berkongsi homologi jujukan asid amino dan persamaan struktur teras kepada kelas histon utama tertentu, tetapi juga mempunyai ciri tersendiri yang berbeza daripada histon utama. Histon kecil ini biasanya menjalankan fungsi khusus metabolisme kromatin. Contohnya, CENPA seperti histon H3 dikaitkan dengan hanya kawasan sentromer kromosom. Histon H2A varian H2A.Z dikaitkan dengan promoter gen yang ditranskripsi secara aktif, dan juga terlibat dalam pencegahan penyebaran heterokromatin senyap.[28] Tambahan pula, H2A.Z mempunyai peranan dalam kromatin untuk kestabilan genom.[29] Satu lagi varian H2A, H2A.X, difosforilkan di S139 di kawasan sekitar pemutusan dwiuntaian dan menandakan rantau ini agar dijalankan pembaikan DNA.[30] Histone H3.3 dikaitkan dengan badan gen yang ditranskripsi secara aktif.[31]
Fungsi sunting
Pemadatan untaian DNA sunting
Histon bertindak sebagai gelendong di sekeliling DNA yang dipilin. Ini membolehkan pemadatan yang diperlukan untuk memuatkan genom besar eukariot di dalam nukleus sel: molekul yang dipadatkan adalah 40,000 kali lebih pendek daripada molekul yang tidak dibungkus.
Kawal atur kromatin sunting
Histones menjalani pengubahsuaian pascaterjemahan yang mengubah interaksinya dengan DNA dan protein nukleus. Histon H3 dan H4 mempunyai ekor panjang yang menonjol dari nukleosom yang boleh diubah suai secara kovalen di beberapa tempat. Pengubahsuaian ekor termasuk pemetilan, pengasetilan, pemfosforilan, pengubikuitinan, pen-SUMO-an, pensitrulinaan dan ADP-peribosilan. Teras histon H2A dan H2B juga boleh diubah suai. Gabungan pengubahsuaian, yang dikenali sebagai tanda histon, dianggap membentuk kod yang dipanggil "kod histon".[32][33] Pengubahsuaian histon bertindak dalam pelbagai proses biologi seperti kawal atur gen, pembaikan DNA, pemeluwapan kromosom (mitosis) dan spermatogenesis (meiosis).[34]
Tatanama biasa pengubahsuaian histon ialah:
- Nama histon (cth., H3)
- Singkatan asid amino satu huruf (cth., K untuk lisina) dan kedudukan asid amino dalam protein
- Jenis pengubahsuaian (Me: metil, P: fosfat, Ac: asetil, Ub: ubikuitin)
- Bilangan pengubahsuaian (hanya Me diketahui berlaku dalam lebih daripada satu salinan bagi setiap sisa. 1, 2 atau 3 ialah mono-, di- atau tripemetilan)
Sebagai contoh, H3K4me1 menandakan pemetilan tunggal sisa keempat (lisina) dari permulaan (terminal N) protein H3.
| Jenis pengubahsuaian |
Histon | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| H3K4 | H3K9 | H3K14 | H3K27 | H3K79 | H3K36 | H4K20 | H2BK5 | H2BK20 | |
| monopemetilan | pengaktifan[35] | pengaktifan[36] | pengaktifan[36] | pengaktifan[36][37] | pengaktifan[36] | pengaktifan[36] | |||
| dipemetilan | penindasan[38] | penindasan[38] | pengaktifan[37] | ||||||
| tripemetilan | pengaktifan[39] | penindasan[36] | penindasan[36] | pengaktifan,[37]penindasan[36] | pengaktifan | penindasan[38] | |||
| pengasetilan | pengaktifan[40] | pengaktifan[39] | pengaktifan[39] | pengaktifan[41] | pengaktifan | ||||
Pengubahsuaian sunting
Katalog besar pengubahsuaian histon telah diterangkan, tetapi pemahaman fungsi kebanyakan masih kekurangan. Secara kolektif, ia dianggap bahawa pengubahsuaian histon mungkin mendasari kod histon, yang mana gabungan pengubahsuaian histon mempunyai makna khusus. Walau bagaimanapun, kebanyakan data berfungsi melibatkan pengubahsuaian histon yang menonjol dalam biokimia untuk kajian terperinci.
Kimia sunting
Pemetilan lisina sunting
Penambahan satu, dua, atau banyak kumpulan metil terhadap lisina mempunyai sedikit kesan ke atas kimia histon; metilasi meninggalkan cas lisina utuh, dan menambah bilangan atom yang minimum supaya interaksi sterik kebanyakannya tidak terjejas. Walau bagaimanapun, protein yang mengandungi domain Tudor, kromo atau PHD, antara lain, boleh mengenali pemetilan lisina dengan kepekaan yang sangat baik, dan dapat membezakan mono-, di- dan trimetil lisina, sehingga ke tahap di mana, dalam sesetengah lisina (cth., H4K20), ketiga-tiga jenis pemetilan nampaknya mempunyai makna yang berbeza. Oleh sebab itu, pemetilan lisina cenderung menjadi tanda yang sangat bermaklumat dan mendominasi fungsi pengubahsuaian histon yang diketahui.
Penserotoninan glutamina sunting
Baru-baru ini telah ditunjukkan, bahawa penambahan kumpulan serotonin ke kedudukan 5 glutamina H3 berlaku dalam sel serotonergik seperti neuron. Ini adalah sebahagian daripada pembezaan sel serotonergik. Pengubahsuaian pascaterjemahan ini berlaku bersama dengan pengubahsuaian H3K4me3. Penserotoninan mempotensikan pengikatan faktor transkripsi umum TFIID ke kotak TATA.[42]
Pemetilan arginina sunting
Apa yang dinyatakan di atas tentang kimia pemetilan lisina juga terpakai dalam metilasi arginina, dan beberapa domain protein—cth., domain Tudor—boleh menerima pemetilan arginina khusus berbanding lisina. Arginina boleh mengalami mono- atau dwipemetilan, dan boleh berbentuk simetri atau tidak simetri, dengan hasil yang berbeza.
Pensitrulinaan arginina sunting
Enzim yang dipanggil peptidilarginina deiminase (PAD) menghidrolisis kumpulan imina arginina dan melekatkan kumpulan keto supaya terdapat satu cas positif yang kurang pada sisa asid amino. Proses ini telah terlibat dalam pengaktifan ekspresi gen dengan menjadikan histon yang diubah suai kurang terikat dengan DNA lalu menjadikan kromatin lebih mudah diakses.[43] PAD juga boleh menghasilkan kesan sebaliknya dengan membuang atau menghalang monopemetilan sisa arginina pada histon, sekaligus menentang kesan positif metilasi arginina dalam aktiviti transkripsi.[44]
Pengasetilan lisina sunting
Penambahan kumpulan asetil mempunyai kesan kimia utama terhadap lisina kerana ia meneutralkan cas positif. Ini mengurangkan daya tarikan elektrostatik antara histon dan tulang belakang DNA bercas negatif, melonggarkan struktur kromatin; histon yang sangat berasetil membentuk kromatin yang lebih mudah diakses, dan cenderung dikaitkan dengan transkripsi aktif. Pengasetilan lisina nampaknya kurang tepat dalam maksud berbanding pemetilan kerana asetiltransferase histon cenderung bertindak terhadap lebih daripada satu lisina; mungkin ini mencerminkan keperluan untuk mengubah berbilang lisina untuk memberi kesan ketara pada struktur kromatin. Cotnoh pengubahsuaian termasuk H3K27ac.
Pemfosforilan serina/treonina/tirosina sunting
Penambahan kumpulan fosfat bercas negatif boleh membawa kepada perubahan besar dalam struktur protein, yang membawa kepada peranan pemfosforilan yang dicirikan dengan baik dalam mengawal fungsi protein. Tidak jelas apakah implikasi struktur pemfosforilan histon, tetapi ia mempunyai fungsi yang jelas sebagai pengubahsuaian pascaterjemahan, dan domain pengikat seperti BRCT telah dicirikan.
Kesan pada transkripsi sunting
Kebanyakan pengubahsuaian histon yang dikaji dengan baik terlibat dalam kawalan transkripsi.
Gen yang ditranskripsi secara aktif sunting
Dua pengubahsuaian histon terutamanya dikaitkan dengan transkripsi aktif:
- Trimetilasi H3 lisina 4 (H3K4me3)
- Trimetilasi ini berlaku dalam promoter gen aktif,[45][46][47] dan dilakukan oleh kompleks COMPASS.[48][49][50] Walaupun ada pemeliharaan pengubahsuaian kompleks dan histon ini daripada yis kepada mamalia, peranan yang dimainkan oleh pengubahsuaian ini tidak jelas sepenuhnya. Walau bagaimanapun, ia adalah tanda yang sangat baik bagi promoter aktif, dan tahap pengubahsuaian histon ini pada promoter gen secara meluas dikaitkan dengan aktiviti transkripsi gen. Pembentukan tanda ini terikat kepada transkripsi dengan cara yang agak rumit: pada awal transkripsi gen, RNA polimerase II mengalami perubahan daripada permulaan kepada pemanjangan, ditandai dengan perubahan keadaan pemfosforilan RNA domain terminal C RNA polimerase II. Enzim yang sama yang memfosforilasi CTD juga memfosforilasi kompleks Rad6[51][52] yang seterusnya menambah penanda ubikuitin kepada H2B K123 (K120 dalam mamalia).[53] H2BK123Ub berlaku di seluruh kawasan yang ditranskripsi, tetapi tanda ini diperlukan agar COMPASS mentrimetilkan H3K4 di promoter.[54][55]
- Tripemetilan H3 lisina 36 (H3K36me3)
- Trimetilasi ini berlaku dalam badan gen aktif dan didepositkan oleh Set2 metiltransferase.[56] Protein ini dikaitkan dengan RNA polimerase II yang memanjang, dan H3K36Me3 menunjukkan gen yang ditranskripsi secara aktif.[57] H3K36Me3 diiktiraf oleh kompleks histon deasetilase Rpd3 yang menghilangkan pengubahsuaian asetil daripada histon sekeliling, meningkatkan pemadatan kromatin dan menindas transkripsi palsu.[58][59][60] Peningkatan pemadatan kromatin menghalang faktor transkripsi daripada mengakses DNA, dan mengurangkan kemungkinan peristiwa transkripsi baharu dimulakan dalam badan gen. Oleh itu, proses ini membantu memastikan transkripsi tidak terganggu.
Gen ditindas sunting
Tiga pengubahsuaian histon terutamanya dikaitkan dengan gen yang ditindas:
- Tripemetilan H3 lisina 27 (H3K27me3)
- Pengubahsuaian histon ini didepositkan oleh kompleks polisikat PRC2.[61] Ia merupakan penanda yang jelas bagi penindasan gen,[62] dan berkemungkinan diikat oleh protein lain untuk melaksanakan fungsi penindasan. Satu lagi kompleks polisikat, PRC1, boleh mengikat H3K27me3[62] dan menambah pengubahsuaian histon H2AK119Ub yang membantu pemadatan kromatin.[63][64] Berdasarkan data ini, nampaknya PRC1 direkrut melalui tindakan PRC2, namun kajian terbaru menunjukkan bahawa PRC1 direkrut ke tapak yang sama tanpa kehadiran PRC2.[65][66]
- Di- dan tripemetilan H3 lisina 9 (H3K9me2/3)
- H3K9me2/3 ialah penanda yang dicirikan dengan baik buatheterokromatin, dan oleh itu, sangat dikaitkan dengan penindasan gen. Pembentukan heterokromatin telah dikaji dengan terbaik dalam yis Schizosaccharomyces pombe, di mana ia dimulakan dengan pengambilan kompleks penyenyapan transkripsi cetusan RNA (RITS) kepada RNA dwiuntaian yang dihasilkan daripada ulangan sentromer.[67] RITS merekrut histon metiltransferase Clr4 yang mendepositkan H3K9me2/3.[68] Proses ini dipanggil pemetilan histon. H3K9Me2/3 berfungsi sebagai tapak pengikat untuk pengambilan Swi6 (protein heterokromatin 1 atau HP1, satu lagi penanda heterokromatin klasik)[69][70] yang seterusnya merekrut aktiviti penindasan lanjut, termasuk pengubah histon seperti histon deasetilase dan histon metiltransferase.[71]
- Tripemetilan H4 lisina 20 (H4K20me3)
- Pengubahsuaian ini berkait rapat dengan heterokromatin,[72][73] walaupun kepentingan fungsinya masih tidak jelas. Tanda ini diletakkan oleh metiltransferase Suv4-20h, yang sekurang-kurangnya sebahagiannya direkrut oleh protein heterkhromatin 1.[72]
Promoter bivalen sunting
Analisis pengubahsuaian histon dalam sel tunjang embrio (dan sel tunjang lain) mendedahkan banyak promoter gen dengan kedua-dua H3K4Me3 dan H3K27Me3, dengan kata lain, promoter ini memiliki kedua-dua penanda pengaktifan dan penindasan secara serentak. Gabungan pengubahsuaian luar biasa ini menandakan gen yang bersedia untuk transkripsi; ia tidak diperlukan dalam sel tunjang, tetapi diperlukan dengan cepat selepas pembezaan kepada beberapa keturunan. Sebaik sahaja sel mula membeza, promoter bivalen ini diselesaikan sama ada menjadi keadaan aktif atau menindas, bergantung pada keturunan yang dipilih.[74]
Fungsi lain sunting
Pembaikan kerosakan DNA sunting
Penandaan tapak kerosakan DNA ialah fungsi penting pengubahsuaian histon. Tanpa penanda pembaikan, DNA akan dimusnahkan oleh kerosakan yang terkumpul daripada sumber seperti sinaran ultraungu matahari.
- Pemfosforilan H2AX serin 139 (γH2AX)
- H2AX berfosforil (juga dikenali sebagai gama-H2AX) ialah penanda bagi pemutusan dwiuntai DNA,[75] dan membentuk sebahagian daripada tindak balas kerosakan DNA.[30][76] H2AX difosforilkan lebih awal selepas pengesanan pemutusan dwiuntai, dan membentuk domain yang memanjang banyak kilobes di kedua-dua belah kerosakan.[75][77][78] Gamma H2AX bertindak sebagai tapak pengikat protein MDC1, yang seterusnya merekrut protein pembaikan DNA utama,[79][80] dan oleh itu, gama-H2AX membentuk bahagian penting dalam jentera yang memastikan kestabilan genom.
- Pengasetilan H3 lisina 56 (H3K56Ac)
- H3K56Acx diperlukan dalam kestabilan genom.[81][82] H3K56 diasetilkan oleh kompleks p300/Rtt109,[83][84][85] tetapi cepat dinyahasetilkan di sekitar tapak kerosakan DNA. Pengasetilan H3K56 juga diperlukan untuk menstabilkan garpu replikasi yang terhenti, mengelakkan garpu replikasi berbahaya runtuh.[86][87] Walaupun pada umumnya, mamalia menggunakan pengubahsuaian histon yang jauh lebih besar daripada mikroorganisma, peranan utama H3K56Ac dalam replikasi DNA hanya wujud dalam kulat, dan ini telah menjadi sasaran dalam pembangunan ubat antibiotik.[88]
- Trimetilasi H3 lisina 36 (H3K36me3)
- H3K36me3 mempunyai keupayaan untuk merekrut kompleks MSH2-MSH6 (hMutSα) bagi laluan pembaikan ketidakpadanan DNA.[89] Secara konsisten, kawasan genom manusia dengan tahap tinggi H3K36me3 mengumpul kurang mutasi somatik disebabkan oleh aktiviti pembaikan yang tidak sepadan.[90]
Pemeluwapan kromosom sunting
- Pemfosforilan H3 serina 10 (fosfo-H3S10)
- Kinase mitosis aurora B memfosforilkan histon H3 di serin 10, mencetuskan lata perubahan yang mengantara pemeluwapan kromosom mitosis.[91][92] Oleh itu, kromosom pekat diwarnakan sangat kuat bagi tanda ini, tetapi pemfosforilan H3S10 juga terdapat di tapak kromosom tertentu di luar mitosis, contohnya dalam heterokromatin perisentrik sel semasa fasa G2. Fosforilasi H3S10 juga telah dikaitkan dengan kerosakan DNA disebabkan oleh pembentukan gelung R di tapak yang banyak ditranskripsi.[93]
- Pemfosforilan H2B serina 10/14 (fosfo-H2BS10/14)
- Pemfosforilan H2B di serina 10 (yis) atau serina 14 (mamalia) juga dikaitkan dengan pemeluwapan kromatin, tetapi untuk tujuan yang sangat berbeza untuk mengantarkan pemeluwapan kromosom semasa apoptosis.[94][95] Tanda ini bukan sekadar pemerhati lewat dalam apoptosis kerana yis yang membawa mutasi sisa ini tahan terhadap kematian sel apoptosis oleh hidrogen peroksida.
Ketagihan sunting
Pengubahsuaian epigenetik ekor histon di kawasan tertentu otak adalah penting dalam ketagihan.[96][97][98] Sebaik sahaja perubahan epigenetik tertentu berlaku, ia kelihatan sebagai "parut molekul" tahan lama yang mungkin menyumbang kepada ketagihan yang berterusan.[96]
Perokok biasanya ketagih nikotin.[99] Dalam hal ini, selepas 7 hari rawatan nikotin tikus, pengasetilan kedua-dua histon H3 dan histon H4 telah meningkat pada promoter FosB dalam akumbens nukleus otak, menyebabkan peningkatan 61% dalam ekspresi FosB.[100] Ini juga akan meningkatkan ekspresi varian sambatan Delta FosB. Dalam akumebs itu, Delta FosB berfungsi sebagai "suis molekul berterusan" dan "protein kawalan induk" dalam pembangunan ketagihan.[101][102]
Berkenaan alkoholisme, dalam tikus yang didedahkan kepada alkohol sehingga 5 hari, terdapat peningkatan dalam pengasetilan histon 3 lisina 9 dalam promoter pronosiseptin dalam kompleks amigdala otak. Pengasetilan ini ialah tanda pengaktifan pronosiseptin. Sistem reseptor opioid nosiseptin/nosiseptin terlibat dalam kesan pengukuhan atau penyesuaian alkohol.[103]
Penggunaan metamfetamina kronik menyebabkan pemetilan lisina di kedudukan 4 histon 3 yang terletak di promoter gen c-fos dan reseptor kemokin CC 2 (ccr2), mengaktifkan gen tersebut dalam akumbens nukleus (NAc).[104] c-fos terkenal kerana penting dalam ketagihan.[105] Gen ccr2 juga penting dalam ketagihan kerana penyahaktifan mutasi gen ini menjejaskan ketagihan.[104]
Sintesis sunting
Langkah pertama penggandaan struktur kromatin ialah sintesis protein histon: H1, H2A, H2B, H3, H4. Protein ini disintesis semasa fasa S kitaran sel. Ada pelbagai mekanisme yang menyumbang kepada peningkatan sintesis histon.
Yis sunting
Yis membawa satu atau dua salinan setiap gen histon, dan salinan-salinan ini tidak berkelompok, tetapi sebaliknya bertaburan di seluruh kromosom. Transkripsi gen histon dikawal oleh pelbagai protein kawal atur gen seperti faktor transkripsi yang mengikat kawasan promoter histon. Dalam yis tunas, gen calon pengaktifan ekspresi gen histon ialah SBF. SBF ialah faktor transkripsi yang diaktifkan ketika lewat fasa G1 apabila ia berpisah daripada penindasnya Whi5. Ini berlaku apabila Whi5 difosforilkan oleh Cdc8 iaitu G1/S Cdk.[106] Penindasan ekspresi gen histon di luar fasa S bergantung kepada protein Hir yang membentuk struktur kromatin tidak aktif di lokus gen histon, menyebabkan pengaktif transkripsi disekat.[107][108]
Metazoa sunting
Dalam metazoa, peningkatan dalam kadar sintesis histon adalah disebabkan oleh peningkatan pemprosesan pra-mRNA kepada bentuk matangnya serta penurunan penguraian mRNA; ini mengakibatkan peningkatan mRNA aktif bagi terjemahan protein histon. Mekanisme pengaktifan mRNA telah diketahui ialah penyingkiran segmen hujung 3' untaian mRNA, dan bergantung pada penyatuan dengan protein pengikat gelung batang (SLBP).[109] SLBP juga menstabilkan mRNA histon semasa fasa S dengan menyekat penguraian oleh nuklease 3'hExo.[110] Tahap SLBP dikawal oleh protein kitaran sel, menyebabkan SLBP terkumpul apabila sel memasuki fasa S dan merosot apabila meninggalkan fasa S. SLBP ditandai bagi penguraian oleh pemfosforilan dua sisa treonina oleh kinase bergantungan siklin, mungkin siklin A/cdk2, ketika akhir fasa S.[111] Metazoa juga mempunyai beberapa salinan gen histon yang dikelompokkan dalam kromosom yang disetempatkan dalam struktur yang dipanggil badan Cajal seperti yang ditentukan oleh analisis tangkapan konformasi kromosom seluruh genom (4C-Seq).[112]
Kaitan antara kawalan kitaran sel dan sintesis sunting
Protein nukleus Ataxia-Telangiectasia (NPAT), juga dikenali sebagai kopengaktif protein nukleus transkripsi histon, ialah faktor transkripsi yang mengaktifkan transkripsi gen histon di kromosom 1 dan 6 sel manusia. NPAT juga merupakan substrat siklin E-Cdk2 yang diperlukan dalam peralihan antara fasa G1 dan fasa S. NPAT mengaktifkan ekspresi gen histon hanya selepas ia telah difosforilkan oleh siklin G1/S-Cdk, E-Cdk2, dalam fasa S awal.[113] Ini menunjukkan hubungan kawal atur penting antara kawalan kitaran sel dan sintesis histon.
Sejarah sunting
Histon ditemui pada tahun 1884 oleh Albrecht Kossel.[114] Perkataan "histon" berasal dari akhir abad ke-19 dan berasal daripada perkataan Jerman "Histon", tetapi perkataan itu sendiri tidak jelas asal usulnya, mungkin daripada bahasa Yunani Purba ἵστημι (hístēmi, "mendirikan") atau ἱστός (histós, "loom").
Pada awal 1960-an, sebelum jenis histon diketahui dan sebelum histon diketahui sangat terpelihara merentasi organisma yang pelbagai taksonomi, James F. Bonner dan rakan-rakannya memulakan kajian terhadap protein ini yang diketahui berkait rapat dengan DNA dalam nukleus organisma yang lebih tinggi.[115] Bonner dan rakan pasca doktoralnya Ru Chih C. Huang menunjukkan bahawa kromatin terpencil tidak akan menyokong transkripsi RNA dalam tabung uji, tetapi jika histon diekstrak daripada kromatin, RNA boleh ditranskripsikan daripada DNA yang tinggal.[116] Kertas mereka menjadi rujukan klasik.[117] Paul T'so dan James Bonner telah mengadakan Kongres Dunia mengenai Kimia dan Biologi Histon pada tahun 1964, di mana ia menjadi jelas bahawa tidak ada persetujuan mengenai bilangan jenis histon, dan tiada siapa yang tahu perbandingannya apabila diasingkan daripada organisma yang berbeza.[118][115] Bonner dan rakan usaha samanya kemudiannya membangunkan kaedah untuk memisahkan setiap jenis histon, menulenkan histon individu, membandingkan komposisi asid amino dalam histon yang sama daripada organisma yang berbeza, dan membandingkan jujukan asid amino histon yang sama daripada organisma yang berbeza dengan kerjasama Emil Smith dari UCLA.[119] Sebagai contoh, mereka mendapati jujukan histon IV sangat terpelihara antara kacang dan timus anak lembu.[119] Walau bagaimanapun, kerja mereka mengenai ciri-ciri biokimia histon individu tidak mendedahkan cara histon berinteraksi antara satu sama lain atau dengan DNA yang mana ia terikat rapat.[118]
Juga pada tahun 1960-an, Vincent Allfrey dan Alfred Mirsky telah mencadangkan berdasarkan analisis histon mereka bahawa pengasetilan dan pemetilan histon boleh menyediakan mekanisme kawalan transkripsi, tetapi tidak mempunyai jenis analisis terperinci yang dapat dijalankan oleh penyiasat lanjutan untuk menunjukkan bagaimana peraturan sedemikian boleh dikhususkan mengikut gen.[120] Sehingga awal 1990-an, histon telah dipandang ringan oleh kebanyakan pengkaji sebagai bahan pembungkus lengai untuk DNA nukleus eukariot, menuruti pandangan berdasarkan sebahagiannya pada model Mark Ptashne dan lain-lain yang percaya bahawa transkripsi diaktifkan oleh protein-DNA dan interaksi protein-protein pada sebahagian besarnya templat DNA yang terdedah seperti dalam bakteria.
Semasa 1980-an, Yahli Lorch dan Roger Kornberg[121] menunjukkan bahawa nukleosom pada promoter teras menghalang permulaan transkripsi secara in vitro, dan Michael Grunstein[122] menunjukkan bahawa histon menindas transkripsi in vivo, membawa kepada idea nukleosom sebagai penindas gen umum. Pelepasan daripada penindasan dipercayai melibatkan pengubahsuaian histon dan tindakan kompleks pembentukan semula kromatin. Vincent Allfrey dan Alfred Mirsky sebelum ini mencadangkan peranan pengubahsuaian histon dalam pengaktifan transkrip,[123] dianggap sebagai manifestasi molekul dalam epigenetik. Michael Grunstein[124] dan David Allis[125] mendapat sokongan bagi cadangan ini dalam kepentingan pengasetilan histon dalam transkripsi yis, dan aktiviti pengaktif transkripsi Gcn5 sebagai histon asetiltransferase.
Penemuan histon H5 nampaknya bermula pada tahun 1970-an,[126] dan ia kini dianggap sebagai isobentuk histon H1.[2][4][5][6]
Rujukan sunting
- ^ Youngson RM (2006). Collins Dictionary of Human Biology. Glasgow: HarperCollins. ISBN 978-0-00-722134-9.
- ^ a b c d Cox M, Nelson DR, Lehninger AL (2005). Lehninger Principles of Biochemistry. San Francisco: W.H. Freeman. ISBN 978-0-7167-4339-2.
- ^ "Histone H2A variants H2AX and H2AZ". Current Opinion in Genetics & Development. 12 (2): 162–9. April 2002. doi:10.1016/S0959-437X(02)00282-4. PMID 11893489.
- ^ a b "Histone Variants Database 2.0". National Center for Biotechnology Information. Dicapai pada 13 January 2017.
- ^ a b "Recognition and classification of histones using support vector machine" (PDF). Journal of Computational Biology. 13 (1): 102–12. 2006. doi:10.1089/cmb.2006.13.102. PMID 16472024.
- ^ a b Hartl DL, Freifelder D, Snyder LA (1988). Basic Genetics. Boston: Jones and Bartlett Publishers. ISBN 978-0-86720-090-4.
- ^ "Histone structure and nucleosome stability". Expert Review of Proteomics. 2 (5): 719–29. October 2005. doi:10.1586/14789450.2.5.719. PMC 1831843. PMID 16209651.
- ^ a b "Crystal structure of the nucleosome core particle at 2.8 A resolution". Nature. 389 (6648): 251–60. September 1997. Bibcode:1997Natur.389..251L. doi:10.1038/38444. PMID 9305837. PDB: 1AOI
- ^ Farkas D (1996). DNA simplified: the hitchhiker's guide to DNA. Washington, D.C: AACC Press. ISBN 978-0-915274-84-0.
- ^ a b Seal, Ruth L.; Denny, Paul; Bruford, Elspeth A.; Gribkova, Anna K.; Landsman, David; Marzluff, William F.; McAndrews, Monica; Panchenko, Anna R.; Shaytan, Alexey K. (October 2022). "A standardized nomenclature for mammalian histone genes". Epigenetics & Chromatin. 15 (1): 34. doi:10.1186/s13072-022-00467-2. ISSN 1756-8935. PMC 9526256 Check
|pmc=value (bantuan). PMID 36180920 Check|pmid=value (bantuan). - ^ "Histone H3.3 maintains genome integrity during mammalian development". Genes & Development. 29 (13): 1377–92. July 2015. doi:10.1101/gad.264150.115. PMC 4511213. PMID 26159997.
- ^ Draizen, Eli J.; Shaytan, Alexey K.; Mariño-Ramírez, Leonardo; Talbert, Paul B.; Landsman, David; Panchenko, Anna R. (2016). "HistoneDB 2.0: a histone database with variants--an integrated resource to explore histones and their variants". Database: The Journal of Biological Databases and Curation. 2016: baw014. doi:10.1093/database/baw014. ISSN 1758-0463. PMC 4795928. PMID 26989147.
- ^ El Kennani, Sara; Adrait, Annie; Shaytan, Alexey K.; Khochbin, Saadi; Bruley, Christophe; Panchenko, Anna R.; Landsman, David; Pflieger, Delphine; Govin, Jérôme (2017). "MS_HistoneDB, a manually curated resource for proteomic analysis of human and mouse histones". Epigenetics & Chromatin. 10: 2. doi:10.1186/s13072-016-0109-x. ISSN 1756-8935. PMC 5223428. PMID 28096900.
- ^ Marashi, F.; Prokopp, K.; Stein, J.; Stein, G. (April 1984). "Evidence for a human histone gene cluster containing H2B and H2A pseudogenes". Proceedings of the National Academy of Sciences of the United States of America. 81 (7): 1936–1940. doi:10.1073/pnas.81.7.1936. ISSN 0027-8424. PMC 345411. PMID 6326092.
- ^ Kardalinou, E.; Eick, S.; Albig, W.; Doenecke, D. (August 1993). "Association of a human H1 histone gene with an H2A pseudogene and genes encoding H2B.1 and H3.1 histones". Journal of Cellular Biochemistry. 52 (4): 375–383. doi:10.1002/jcb.240520402. ISSN 0730-2312. PMID 8227173.
- ^ a b "On the origin of the histone fold". BMC Structural Biology. 7: 17. March 2007. doi:10.1186/1472-6807-7-17. PMC 1847821. PMID 17391511.
- ^ "Structure of histone-based chromatin in Archaea". Science. 357 (6351): 609–612. August 2017. Bibcode:2017Sci...357..609M. doi:10.1126/science.aaj1849. PMC 5747315. PMID 28798133. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b c "Structure and function of archaeal histones". PLOS Genetics. 14 (9): e1007582. September 2018. Bibcode:2018BpJ...114..446H. doi:10.1371/journal.pgen.1007582. PMC 6136690. PMID 30212449.
- ^ "Long distance PELDOR measurements on the histone core particle". Journal of the American Chemical Society. 131 (4): 1348–9. February 2009. doi:10.1021/ja807918f. PMC 3501648. PMID 19138067.
- ^ "The tale beyond the tail: histone core domain modifications and the regulation of chromatin structure". Nucleic Acids Research. 34 (9): 2653–62. 19 May 2006. doi:10.1093/nar/gkl338. PMC 1464108. PMID 16714444.
- ^ "Scratching the (lateral) surface of chromatin regulation by histone modifications". Nature Structural & Molecular Biology. 20 (6): 657–61. June 2013. doi:10.1038/nsmb.2581. PMID 23739170.
- ^ Allison LA (2012). Fundamental Molecular Biology (ed. Second). United States of America: John Wiley & Sons. m/s. 102. ISBN 9781118059814.
- ^ "Those amazing dinoflagellate chromosomes". Cell Research. 13 (4): 215–7. August 2003. doi:10.1038/sj.cr.7290166. PMID 12974611.
- ^ "Chromatin: packaging without nucleosomes". Current Biology. 22 (24): R1040-3. December 2012. doi:10.1016/j.cub.2012.10.052. PMID 23257187.
- ^ "Origin of H1 linker histones". FASEB Journal. 15 (1): 34–42. January 2001. doi:10.1096/fj.00-0237rev. PMID 11149891.
- ^ "The origin of chromosomal histones in a 30S ribosomal protein". Gene. 726: 144155. February 2020. doi:10.1016/j.gene.2019.144155. PMID 31629821.
- ^ "Nuclear and chromatin composition of mammalian gametes and early embryos". Biochemistry and Cell Biology. 70 (10–11): 856–66. 1992. doi:10.1139/o92-134. PMID 1297351.
- ^ "Variant histone H2A.Z is globally localized to the promoters of inactive yeast genes and regulates nucleosome positioning". PLOS Biology. 3 (12): e384. December 2005. doi:10.1371/journal.pbio.0030384. PMC 1275524. PMID 16248679.
- ^ "Precise deposition of histone H2A.Z in chromatin for genome expression and maintenance". Biochim Biophys Acta. 1819 (3–4): 290–302. October 2011. doi:10.1016/j.bbagrm.2011.10.004. PMID 22027408.
- ^ a b "A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage". Current Biology. 10 (15): 886–95. 2000. doi:10.1016/S0960-9822(00)00610-2. PMID 10959836.
- ^ "The histone variant H3.3 marks active chromatin by replication-independent nucleosome assembly". Molecular Cell. 9 (6): 1191–200. June 2002. doi:10.1016/S1097-2765(02)00542-7. PMID 12086617.
- ^ "The language of covalent histone modifications". Nature. 403 (6765): 41–5. January 2000. Bibcode:2000Natur.403...41S. doi:10.1038/47412. PMID 10638745.
- ^ "Translating the histone code" (PDF). Science. 293 (5532): 1074–80. August 2001. CiteSeerX 10.1.1.453.900. doi:10.1126/science.1063127. PMID 11498575.
- ^ "Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis". Acta Histochemica et Cytochemica. 44 (4): 183–90. August 2011. doi:10.1267/ahc.11027. PMC 3168764. PMID 21927517.
- ^ "Histone H3K4 demethylases are essential in development and differentiation". Biochemistry and Cell Biology. 85 (4): 435–43. August 2007. doi:10.1139/o07-057. PMID 17713579.
- ^ a b c d e f g h "High-resolution profiling of histone methylations in the human genome". Cell. 129 (4): 823–37. May 2007. doi:10.1016/j.cell.2007.05.009. PMID 17512414. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b c "DOT1L/KMT4 recruitment and H3K79 methylation are ubiquitously coupled with gene transcription in mammalian cells". Molecular and Cellular Biology. 28 (8): 2825–39. April 2008. doi:10.1128/MCB.02076-07. PMC 2293113. PMID 18285465. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b c "Determination of enriched histone modifications in non-genic portions of the human genome". BMC Genomics. 10: 143. March 2009. doi:10.1186/1471-2164-10-143. PMC 2667539. PMID 19335899.
- ^ a b c "The landscape of histone modifications across 1% of the human genome in five human cell lines". Genome Research. 17 (6): 691–707. June 2007. doi:10.1101/gr.5704207. PMC 1891331. PMID 17567990. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "H3 lysine 4 is acetylated at active gene promoters and is regulated by H3 lysine 4 methylation". PLOS Genetics. 7 (3): e1001354. March 2011. doi:10.1371/journal.pgen.1001354. PMC 3069113. PMID 21483810. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Histone H3K27ac separates active from poised enhancers and predicts developmental state". Proceedings of the National Academy of Sciences of the United States of America. 107 (50): 21931–6. December 2010. doi:10.1073/pnas.1016071107. PMC 3003124. PMID 21106759. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3". Nature. 567 (7749): 535–539. March 2019. Bibcode:2019Natur.567..535F. doi:10.1038/s41586-019-1024-7. PMC 6557285. PMID 30867594. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Citrullination regulates pluripotency and histone H1 binding to chromatin". Nature. 507 (7490): 104–8. March 2014. Bibcode:2014Natur.507..104C. doi:10.1038/nature12942. PMC 4843970. PMID 24463520. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Histone deimination antagonizes arginine methylation". Cell. 118 (5): 545–53. September 2004. doi:10.1016/j.cell.2004.08.020. PMID 15339660. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "The Paf1 complex is required for histone H3 methylation by COMPASS and Dot1p: linking transcriptional elongation to histone methylation". Molecular Cell. 11 (3): 721–9. March 2003. doi:10.1016/S1097-2765(03)00091-1. PMID 12667454. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Targeted recruitment of Set1 histone methylase by elongating Pol II provides a localized mark and memory of recent transcriptional activity". Molecular Cell. 11 (3): 709–19. March 2003. doi:10.1016/S1097-2765(03)00092-3. PMID 12667453.
- ^ "Genomic maps and comparative analysis of histone modifications in human and mouse". Cell. 120 (2): 169–81. January 2005. doi:10.1016/j.cell.2005.01.001. PMID 15680324. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "COMPASS, a histone H3 (Lysine 4) methyltransferase required for telomeric silencing of gene expression". The Journal of Biological Chemistry. 277 (13): 10753–5. March 2002. doi:10.1074/jbc.C200023200. PMID 11805083.
- ^ "The Saccharomyces cerevisiae Set1 complex includes an Ash2 homologue and methylates histone 3 lysine 4". The EMBO Journal. 20 (24): 7137–48. December 2001. doi:10.1093/emboj/20.24.7137. PMC 125774. PMID 11742990.
- ^ "A trithorax-group complex purified from Saccharomyces cerevisiae is required for methylation of histone H3". Proceedings of the National Academy of Sciences of the United States of America. 99 (1): 90–4. January 2002. Bibcode:2002PNAS...99...90N. doi:10.1073/pnas.221596698. PMC 117519. PMID 11752412.
- ^ "The Bur1/Bur2 complex is required for histone H2B monoubiquitination by Rad6/Bre1 and histone methylation by COMPASS". Molecular Cell. 20 (4): 589–99. November 2005. doi:10.1016/j.molcel.2005.09.010. PMID 16307922.
- ^ "Regulation of the ubiquitin-conjugating enzyme hHR6A by CDK-mediated phosphorylation". The EMBO Journal. 21 (8): 2009–18. April 2002. doi:10.1093/emboj/21.8.2009. PMC 125963. PMID 11953320.
- ^ "Rad6-dependent ubiquitination of histone H2B in yeast". Science. 287 (5452): 501–4. January 2000. Bibcode:2000Sci...287..501R. doi:10.1126/science.287.5452.501. PMID 10642555.
- ^ "Ubiquitination of histone H2B regulates H3 methylation and gene silencing in yeast". Nature. 418 (6893): 104–8. July 2002. Bibcode:2002Natur.418..104S. doi:10.1038/nature00883. PMID 12077605.
- ^ "Methylation of histone H3 by COMPASS requires ubiquitination of histone H2B by Rad6". The Journal of Biological Chemistry. 277 (32): 28368–71. August 2002. doi:10.1074/jbc.C200348200. PMID 12070136.
- ^ "Set2 is a nucleosomal histone H3-selective methyltransferase that mediates transcriptional repression". Molecular and Cellular Biology. 22 (5): 1298–306. March 2002. doi:10.1128/MCB.22.5.1298-1306.2002. PMC 134702. PMID 11839797. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Association of the histone methyltransferase Set2 with RNA polymerase II plays a role in transcription elongation". The Journal of Biological Chemistry. 277 (51): 49383–8. December 2002. doi:10.1074/jbc.M209294200. PMID 12381723.
- ^ "Histone H3 methylation by Set2 directs deacetylation of coding regions by Rpd3S to suppress spurious intragenic transcription". Cell. 123 (4): 581–92. November 2005. doi:10.1016/j.cell.2005.10.023. PMID 16286007. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Cotranscriptional set2 methylation of histone H3 lysine 36 recruits a repressive Rpd3 complex". Cell. 123 (4): 593–605. November 2005. doi:10.1016/j.cell.2005.10.025. PMID 16286008. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Eaf3 chromodomain interaction with methylated H3-K36 links histone deacetylation to Pol II elongation". Molecular Cell. 20 (6): 971–8. December 2005. doi:10.1016/j.molcel.2005.11.021. PMID 16364921.
- ^ "Histone methyltransferase activity associated with a human multiprotein complex containing the Enhancer of Zeste protein". Genes & Development. 16 (22): 2893–905. November 2002. doi:10.1101/gad.1035902. PMC 187479. PMID 12435631.
- ^ a b "Role of histone H3 lysine 27 methylation in Polycomb-group silencing". Science. 298 (5595): 1039–43. November 2002. Bibcode:2002Sci...298.1039C. doi:10.1126/science.1076997. PMID 12351676. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Polycomb group proteins Ring1A/B link ubiquitylation of histone H2A to heritable gene silencing and X inactivation". Developmental Cell. 7 (5): 663–76. November 2004. doi:10.1016/j.devcel.2004.10.005. PMID 15525528. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Role of histone H2A ubiquitination in Polycomb silencing". Nature. 431 (7010): 873–8. October 2004. Bibcode:2004Natur.431..873W. doi:10.1038/nature02985. PMID 15386022.
- ^ "RYBP-PRC1 complexes mediate H2A ubiquitylation at polycomb target sites independently of PRC2 and H3K27me3". Cell. 148 (4): 664–78. February 2012. doi:10.1016/j.cell.2011.12.029. PMC 3281992. PMID 22325148. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "PCGF homologs, CBX proteins, and RYBP define functionally distinct PRC1 family complexes". Molecular Cell. 45 (3): 344–56. February 2012. doi:10.1016/j.molcel.2012.01.002. PMC 3293217. PMID 22325352. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "RNAi-mediated targeting of heterochromatin by the RITS complex". Science. 303 (5658): 672–6. January 2004. Bibcode:2004Sci...303..672V. doi:10.1126/science.1093686. PMC 3244756. PMID 14704433.
- ^ "Regulation of chromatin structure by site-specific histone H3 methyltransferases". Nature. 406 (6796): 593–9. August 2000. Bibcode:2000Natur.406..593R. doi:10.1038/35020506. PMID 10949293. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain". Nature. 410 (6824): 120–4. March 2001. Bibcode:2001Natur.410..120B. doi:10.1038/35065138. PMID 11242054.
- ^ "Methylation of histone H3 lysine 9 creates a binding site for HP1 proteins". Nature. 410 (6824): 116–20. March 2001. Bibcode:2001Natur.410..116L. doi:10.1038/35065132. PMID 11242053.
- ^ "Binding of DNA-bending non-histone proteins destabilizes regular 30-nm chromatin structure". PLOS Computational Biology. 13 (1): e1005365. January 2017. Bibcode:2017PLSCB..13E5365B. doi:10.1371/journal.pcbi.1005365. PMC 5305278. PMID 28135276.
- ^ a b "A silencing pathway to induce H3-K9 and H4-K20 trimethylation at constitutive heterochromatin". Genes & Development. 18 (11): 1251–62. June 2004. doi:10.1101/gad.300704. PMC 420351. PMID 15145825. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Heterochromatin and tri-methylated lysine 20 of histone H4 in animals". Journal of Cell Science. 117 (Pt 12): 2491–501. May 2004. doi:10.1242/jcs.01238. PMID 15128874. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "A bivalent chromatin structure marks key developmental genes in embryonic stem cells". Cell. 125 (2): 315–26. April 2006. doi:10.1016/j.cell.2006.02.041. PMID 16630819. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b "DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139". The Journal of Biological Chemistry. 273 (10): 5858–68. March 1998. doi:10.1074/jbc.273.10.5858. PMID 9488723.
- ^ "Genomic instability in mice lacking histone H2AX". Science. 296 (5569): 922–7. May 2002. Bibcode:2002Sci...296..922C. doi:10.1126/science.1069398. PMC 4721576. PMID 11934988. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Distribution and dynamics of chromatin modification induced by a defined DNA double-strand break". Current Biology. 14 (19): 1703–11. October 2004. doi:10.1016/j.cub.2004.09.047. PMC 4493763. PMID 15458641. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Megabase chromatin domains involved in DNA double-strand breaks in vivo". The Journal of Cell Biology. 146 (5): 905–16. September 1999. doi:10.1083/jcb.146.5.905. PMC 2169482. PMID 10477747.
- ^ "MDC1 is a mediator of the mammalian DNA damage checkpoint". Nature. 421 (6926): 961–6. February 2003. Bibcode:2003Natur.421..961S. doi:10.1038/nature01446. PMID 12607005.
- ^ "Assembly and function of DNA double-strand break repair foci in mammalian cells". DNA Repair. 9 (12): 1219–28. December 2010. doi:10.1016/j.dnarep.2010.09.010. PMID 21035408.
- ^ "Characterization of lysine 56 of histone H3 as an acetylation site in Saccharomyces cerevisiae". The Journal of Biological Chemistry. 280 (28): 25949–52. July 2005. doi:10.1074/jbc.C500181200. PMID 15888442.
|hdl-access=requires|hdl=(bantuan) - ^ "A role for cell-cycle-regulated histone H3 lysine 56 acetylation in the DNA damage response". Nature. 436 (7048): 294–8. July 2005. Bibcode:2005Natur.436..294M. doi:10.1038/nature03714. PMID 16015338.
- ^ "Yeast Rtt109 promotes genome stability by acetylating histone H3 on lysine 56". Science. 315 (5812): 649–52. February 2007. Bibcode:2007Sci...315..649D. doi:10.1126/science.1135862. PMC 3334813. PMID 17272722.
- ^ "Rtt109 acetylates histone H3 lysine 56 and functions in DNA replication". Science. 315 (5812): 653–5. February 2007. Bibcode:2007Sci...315..653H. doi:10.1126/science.1133234. PMID 17272723.
- ^ "CBP/p300-mediated acetylation of histone H3 on lysine 56". Nature. 459 (7243): 113–7. May 2009. Bibcode:2009Natur.459..113D. doi:10.1038/nature07861. PMC 2756583. PMID 19270680.
- ^ "Acetylation of lysine 56 of histone H3 catalyzed by RTT109 and regulated by ASF1 is required for replisome integrity". The Journal of Biological Chemistry. 282 (39): 28587–96. September 2007. doi:10.1074/jbc.M702496200. PMID 17690098.
- ^ "Histone H3 lysine 56 acetylation and the response to DNA replication fork damage". Molecular and Cellular Biology. 32 (1): 154–72. January 2012. doi:10.1128/MCB.05415-11. PMC 3255698. PMID 22025679. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Modulation of histone H3 lysine 56 acetylation as an antifungal therapeutic strategy". Nature Medicine. 16 (7): 774–80. July 2010. doi:10.1038/nm.2175. PMC 4108442. PMID 20601951. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "The histone mark H3K36me3 regulates human DNA mismatch repair through its interaction with MutSα". Cell. 153 (3): 590–600. April 2013. doi:10.1016/j.cell.2013.03.025. PMC 3641580. PMID 23622243.
- ^ "Clustered Mutation Signatures Reveal that Error-Prone DNA Repair Targets Mutations to Active Genes". Cell. 170 (3): 534–547.e23. July 2017. doi:10.1016/j.cell.2017.07.003. PMID 28753428.
|hdl-access=requires|hdl=(bantuan) - ^ "A cascade of histone modifications induces chromatin condensation in mitosis". Science. 343 (6166): 77–80. January 2014. Bibcode:2014Sci...343...77W. doi:10.1126/science.1244508. PMID 24385627. Unknown parameter
|displayauthors=ignored (bantuan);|hdl-access=requires|hdl=(bantuan) - ^ "Regulation of chromatin structure by histone H3S10 phosphorylation". Chromosome Research. 14 (4): 393–404. 2006. doi:10.1007/s10577-006-1063-4. PMID 16821135.
- ^ "R loops are linked to histone H3 S10 phosphorylation and chromatin condensation". Molecular Cell. 52 (4): 583–90. November 2013. doi:10.1016/j.molcel.2013.10.006. PMID 24211264. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Apoptotic phosphorylation of histone H2B is mediated by mammalian sterile twenty kinase". Cell. 113 (4): 507–17. May 2003. doi:10.1016/s0092-8674(03)00355-6. PMID 12757711. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Sterile 20 kinase phosphorylates histone H2B at serine 10 during hydrogen peroxide-induced apoptosis in S. cerevisiae". Cell. 120 (1): 25–36. January 2005. doi:10.1016/j.cell.2004.11.016. PMID 15652479.
- ^ a b "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews. Neuroscience. 12 (11): 623–37. October 2011. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
- ^ Hitchcock LN, Lattal KM (2014). "Histone-mediated epigenetics in addiction". Epigenetics and Neuroplasticity—Evidence and Debate. Prog Mol Biol Transl Sci. Progress in Molecular Biology and Translational Science. 128. Academic Press. m/s. 51–87. doi:10.1016/B978-0-12-800977-2.00003-6. ISBN 9780128009772. PMC 5914502. PMID 25410541.
- ^ "Epigenetic regulation in substance use disorders". Current Psychiatry Reports. 12 (2): 145–53. April 2010. doi:10.1007/s11920-010-0099-5. PMC 2847696. PMID 20425300.
- ^ "Is nicotine addictive?".
- ^ "Molecular mechanism for a gateway drug: epigenetic changes initiated by nicotine prime gene expression by cocaine". Science Translational Medicine. 3 (107): 107ra109. November 2011. doi:10.1126/scitranslmed.3003062. PMC 4042673. PMID 22049069. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–37. November 2014. doi:10.3109/00952990.2014.933840. PMID 25083822.
- ^ "DeltaFosB: a sustained molecular switch for addiction". Proceedings of the National Academy of Sciences of the United States of America. 98 (20): 11042–6. September 2001. Bibcode:2001PNAS...9811042N. doi:10.1073/pnas.191352698. PMC 58680. PMID 11572966.
- ^ "Ethanol induces epigenetic modulation of prodynorphin and pronociceptin gene expression in the rat amygdala complex". Journal of Molecular Neuroscience. 49 (2): 312–9. February 2013. doi:10.1007/s12031-012-9829-y. PMID 22684622.
- ^ a b "Epigenetic landscape of amphetamine and methamphetamine addiction in rodents". Epigenetics. 10 (7): 574–80. 2015. doi:10.1080/15592294.2015.1055441. PMC 4622560. PMID 26023847.
- ^ "Using c-fos to study neuronal ensembles in corticostriatal circuitry of addiction". Brain Research. 1628 (Pt A): 157–73. December 2015. doi:10.1016/j.brainres.2014.11.005. PMC 4427550. PMID 25446457.
- ^ "Cln3 activates G1-specific transcription via phosphorylation of the SBF bound repressor Whi5". Cell. 117 (7): 887–98. June 2004. doi:10.1016/j.cell.2004.05.025. PMID 15210110.
- ^ "Identification of a new set of cell cycle-regulatory genes that regulate S-phase transcription of histone genes in Saccharomyces cerevisiae". Molecular and Cellular Biology. 12 (11): 5249–59. November 1992. doi:10.1128/mcb.12.11.5249. PMC 360458. PMID 1406694.
- ^ "A role for transcriptional repressors in targeting the yeast Swi/Snf complex". Molecular Cell. 4 (1): 75–83. July 1999. doi:10.1016/S1097-2765(00)80189-6. PMID 10445029.
- ^ "A novel zinc finger protein is associated with U7 snRNP and interacts with the stem-loop binding protein in the histone pre-mRNP to stimulate 3'-end processing". Genes & Development. 16 (1): 58–71. January 2002. doi:10.1101/gad.932302. PMC 155312. PMID 11782445.
- ^ "A 3' exonuclease that specifically interacts with the 3' end of histone mRNA". Molecular Cell. 12 (2): 295–305. August 2003. doi:10.1016/S1097-2765(03)00278-8. PMID 14536070.
- ^ "Phosphorylation of stem-loop binding protein (SLBP) on two threonines triggers degradation of SLBP, the sole cell cycle-regulated factor required for regulation of histone mRNA processing, at the end of S phase". Molecular and Cellular Biology. 23 (5): 1590–601. March 2003. doi:10.1128/MCB.23.5.1590-1601.2003. PMC 151715. PMID 12588979.
- ^ "Cajal bodies are linked to genome conformation". Nature Communications. 7: 10966. March 2016. Bibcode:2016NatCo...710966W. doi:10.1038/ncomms10966. PMC 4802181. PMID 26997247. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "NPAT links cyclin E-Cdk2 to the regulation of replication-dependent histone gene transcription". Genes & Development. 14 (18): 2283–97. September 2000. doi:10.1101/GAD.827700. PMC 316937. PMID 10995386.
- ^ Luck JM (1965). "Histone Chemistry: the Pioneers". Dalam Bonner J, Ts'o P (penyunting). The Nucleohistones. San Francisco, London, and Amsterdam: Holden-Day, Inc.
- ^ a b "Chapters from my life". Annual Review of Plant Physiology and Plant Molecular Biology. 45: 1–23. 1994. doi:10.1146/annurev.pp.45.060194.000245.
- ^ "Histone, a suppressor of chromosomal RNA synthesis". Proceedings of the National Academy of Sciences of the United States of America. 48 (7): 1216–22. July 1962. Bibcode:1962PNAS...48.1216H. doi:10.1073/pnas.48.7.1216. PMC 220935. PMID 14036409.
- ^ "Huang R C & Bonner J. Histone, a suppressor of chromosomal RNA synthesis. Proc. Nat. Acad. Sci. US 48:1216-22, 1962" (PDF). Citation Classics (12): 79. 20 March 1978.
- ^ a b James Bonner and Paul T'so (1965) The Nucleohistones. Holden-Day Inc, San Francisco, London, Amsterdam.
- ^ a b "Calf and pea histone IV. 3. Complete amino acid sequence of pea seedling histone IV; comparison with the homologous calf thymus histone". The Journal of Biological Chemistry. 244 (20): 5669–79. October 1969. doi:10.1016/S0021-9258(18)63612-9. PMID 5388597.
- ^ "Acetylation and methylation of histones and their possible role in the regulation of RNA synthesis". Proceedings of the National Academy of Sciences of the United States of America. 51 (5): 786–94. May 1964. Bibcode:1964PNAS...51..786A. doi:10.1073/pnas.51.5.786. PMC 300163. PMID 14172992.
- ^ "Nucleosomes inhibit the initiation of transcription but allow chain elongation with the displacement of histones". Cell. 49 (2): 203–10. April 1987. doi:10.1016/0092-8674(87)90561-7. PMID 3568125.
- ^ "Extremely conserved histone H4 N terminus is dispensable for growth but essential for repressing the silent mating loci in yeast" (PDF). Cell. 55 (1): 27–39. October 1988. doi:10.1016/0092-8674(88)90006-2. PMID 3048701.
- ^ "RNA synthesis and histone acetylation during the course of gene activation in lymphocytes". Proceedings of the National Academy of Sciences of the United States of America. 55 (4): 805–12. April 1966. Bibcode:1966PNAS...55..805P. doi:10.1073/pnas.55.4.805. PMC 224233. PMID 5219687.
- ^ "Yeast histone H4 N-terminal sequence is required for promoter activation in vivo" (PDF). Cell. 65 (6): 1023–31. June 1991. doi:10.1016/0092-8674(91)90554-c. PMID 2044150.
- ^ "Tetrahymena histone acetyltransferase A: a homolog to yeast Gcn5p linking histone acetylation to gene activation". Cell. 84 (6): 843–51. March 1996. doi:10.1016/s0092-8674(00)81063-6. PMID 8601308.
- ^ "The conformation of histone H5. Isolation and characterisation of the globular segment". European Journal of Biochemistry. 88 (2): 363–71. August 1978. doi:10.1111/j.1432-1033.1978.tb12457.x. PMID 689022.
Pautan luar sunting
- HistoneDB 2.0 - Pangkalan data histon dan varian di NCBI
- Kromatin, Histon & Cathepsin ; PMAP Peta Proteolisis-animasi