Sibutramina
Sibutramina, dahulunya dijual di bawah jenama Meridia, antara lain, ialah penahan selera makan yang telah dihentikan di banyak negara. Ia berfungsi sebagai perencat pengambilan semula serotonin-norepinefrina, serupa dengan antidepresan trisiklik. Sehingga 2010, ia telah dipasarkan secara meluas dan ditetapkan sebagai rawawtan tambahan dalam rawatan obesiti bersama dengan diet dan senaman. Ia telah dikaitkan dengan peningkatan penyakit kardiovaskular dan strok, dan telah ditarik balik daripada pasaran pada tahun 2010 di beberapa negara dan wilayah termasuk Australia,[2] Kanada,[3] China,[4] Kesatuan Eropah,[5] Hong Kong,[6] India,[7] Mexico, New Zealand,[8] Filipina,[9] Thailand,[10] United Kingdom,[11] dan Amerika Syarikat.[12] Walau bagaimanapun, ubat itu masih tersedia di beberapa negara.[13]
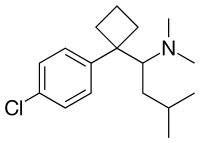 | |
 Sibutramina (atas), (S)-(−)-sibutramina (bawah) | |
| Data klinikal | |
|---|---|
| Nama dagang | Meridia, lain-lain |
| Nama lain | BTS-54524 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a601110 |
| Kategori kehamilan |
|
| Kaedah pemberian | Mulut (kapsul) |
| Kod ATC | |
| Status perundangan | |
| Status perundangan | |
| Data farmakokinetik | |
| Bioketersediaan | Resapan 77%, metabolisme pertama ketara |
| Pengikatan protein | 97% (94% bagi metabolit desmetil, M1 & M2) |
| Metabolisme | Hati (dibantu CYP3A4) |
| Penyingkiran separuh hayat | 1 jam (sibutramina), 14 jam (M1) & 16 jam (M2) |
| Perkumuhan | Kencing (77%), tahi (8%) |
| Pengecam | |
| |
| Nombor CAS |
|
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.130.097 |
| Data kimia dan fizikal | |
| Formula | C17H26ClN |
| Jisim molar | 279.85 g·mol−1 |
| Model 3D (JSmol) | |
| |
| |
| (verify) | |
Sibutramina pada asalnya dibangunkan pada tahun 1988 oleh Boots di Nottingham, UK,[14] dan dikeluarkan dan dipasarkan oleh Abbott Laboratories, dan dijual di bawah pelbagai jenama termasuk Reductil, Meridia, Siredia, dan Sibutrex sebelum pengeluarannya pada 2010 daripada kebanyakan pasaran. Ia diklasifikasikan sebagai bahan terkawal Jadual IV di Amerika Syarikat.
Sehingga 2018, FDA masih menemui sibutramina dalam lebih 700 suplemen diet yang dipasarkan sebagai "semula jadi", "tradisional" atau "ubat herba".
Kegunaan perubatan
suntingSibutramina telah digunakan untuk menghasilkan penindasan selera untuk tujuan mencapai penurunan berat badan dalam rawatan pesakit dengan obesiti.
Kontraindikasi
suntingSibutramina dikontraindikasikan pada pesakit dengan:
- Keadaan psikiatri seperti bulimia nervosa, anoreksia nervosa, kemurungan serius atau mania yang sedia ada
- Pesakit yang mempunyai sejarah atau kecenderungan untuk penyalahgunaan dadah atau alkohol
- Hipersensitiviti kepada ubat atau mana-mana bahan tidak aktif
- Pesakit di bawah umur 18 dan ke atas 65 tahun[15]
- Rawatan serentak dengan perencat MAO, antidepresan atau ubat aktif berpusat lain, terutamanya anoretik lain
- Sejarah penyakit arteri periferal
- Hipertensi yang tidak dikawal secukupnya (cth., > 145/90 mmHg), berhati-hati dalam hipertensi terkawal
- Hipertensi pulmonari sedia ada
- Kerosakan sedia ada di injap jantung, penyakit jantung koronari, kegagalan jantung kongestif, aritmia serius, infarksi miokardium sebelumnya
- Sejarah penyakit arteri koronari (cth., angina, sejarah infarksi miokardium), kegagalan jantung kongestif, takikardia, penyakit oklusif arteri periferal, aritmia atau penyakit serebrovaskular (strok atau serangan iskemia sementara (TIA))[15]
- Strok atau serangan iskemia sementara (TIA)
- Hipertiroidisme (kelenjar tiroid yang terlalu aktif)
- Glaukoma sudut tertutup
- Gangguan sawan
- Pembesaran kelenjar prostat dengan penahanan kencing (kontraindikasi relatif)
- Feokromositoma
- Wanita hamil dan menyusu (kontraindikasi relatif)
Kesan sampingan
suntingBilangan kejadian kardiovaskular yang lebih tinggi telah diperhatikan pada orang yang mengambil sibutramina berbanding kawalan (11.4% berbanding 10.0%).[16] Pada tahun 2010, FDA menyatakan kebimbangan bahawa sibutramina meningkatkan risiko serangan jantung dan strok pada pesakit yang mempunyai sejarah penyakit kardiovaskular.[16]
Kesan sampingan yang kerap dihadapi ialah: mulut kering, selera makan meningkat secara paradoks, loya, rasa pelik di dalam mulut, sakit perut, sembelit, sukar tidur, pening, mengantuk, senggugut/sakit, sakit kepala, kemerahan, atau sakit sendi/otot.
Dalam semakan Cochrane 2016, sibutramina didapati meningkatkan tekanan darah dan kadar denyutan jantung dengan ketara dalam sesetengah pesakit, dan dalam semakan kemas kini pada 2021, sibutramina tidak dimasukkan kerana telah ditarik balik daripada pasaran.[17] Apabila digunakan, pemantauan tekanan darah tetap perlu dilakukan.
Kesan sampingan berikut jarang berlaku tetapi serius dan memerlukan rawatan perubatan segera: aritmia jantung, parestesia, perubahan mental/mood (cth, keseronokan, kegelisahan, kekeliruan, kemurungan, pemikiran bunuh diri yang jarang berlaku).
Gejala yang memerlukan perhatian perubatan segera ialah sawan, masalah membuang air kecil, lebam atau pendarahan yang tidak normal, melena, hematemesis, jaundis, demam dan kekakuan, sakit dada, hemiplegia, penglihatan tidak normal, dispnea dan edema.
Pada masa ini, tiada kes hipertensi pulmonari telah dicatatkan. (Fenfluramina daripada kombinasi "Fen-Phen" 1990-an memaksa pelepasan neurotransmiter yang berlebihan—tindakan berbeza. Fentermina tidak terlibat dalam isu jantung fenfluramina yang jarang berlaku—tetapi penting secara klinikal.)
Interaksi
suntingSibutramina mempunyai beberapa interaksi klinikal yang signifikan. Penggunaan serentak sibrutamina dengan perencat monoamina oksidase (MAOI, cth., selegilina) tidak ditunjukkan, kerana ia boleh meningkatkan risiko sindrom serotonin, tindak balas buruk ubat yang agak jarang berlaku tetapi serius.[18] Sibutramina tidak boleh diambil dalam masa dua minggu selepas menghentikan atau memulakan MAOI. Mengambil kedua-dua sibutramina dan ubat-ubatan tertentu yang digunakan dalam rawatan migrain—seperti ergolina dan triptan—serta opioid, juga boleh meningkatkan risiko sindrom serotonin, seperti juga penggunaan lebih daripada satu perencat pengambilan semula serotonin pada masa yang sama.[18]
Penggunaan serentak sibutramina dan ubat-ubatan yang menghalang CYP3A4, seperti ketokonazola dan eritromisin, boleh meningkatkan tahap plasma sibutramina.[19] Sibutramina tidak menjejaskan keberkesanan kontraseptif hormon.[18]
Farmakologi
suntingFarmakodinamik
suntingSibutramina ialah perencat pengambilan semula serotonin-norepinefrina (SNRI) yang, mengurangkan pengambilan semula norepinefrina (sebanyak ~73%), serotonin (sebanyak ~54%), dan dopamina (sebanyak ~16%) pada manusia,[20] dengan itu meningkatkan tahap bahan ini dalam celah sinaptik dan membantu meningkatkan rasa kenyang; tindakan serotonergik, khususnya, dianggap mempengaruhi selera makan. Ejen anorektik yang lebih tua seperti amfetamina dan fenfluramina memaksa pembebasan neurotransmiter ini berbanding menjejaskan pengambilan semulanya.[21]
Mekanisme tindakan sibutramina adalah serupa dengan antidepresan trisiklik, dan ia telah menunjukkan kesan antidepresan dalam model kemurungan haiwan.[14] Ia telah diluluskan oleh Pentadbiran Makanan dan Dadah (FDA) pada November 1997[22] bagi rawatan obesiti.
Sibutramina dilaporkan sebagai prodrug kepada dua metabolit aktif, desmetilsibutramina (M1; BTS-54354) dan didesmetilsibutramina (M2; BTS-54505), dengan potensi yang lebih besar sebagai perencat pengambilan semula monoamina.[23][24] Kajian lanjut telah menunjukkan bahawa (R)-enantiomer setiap metabolit memberikan kesan anorektik yang lebih kuat daripada (S) -enantiomer.[25]
Tidak seperti penindas selera serotonergik lain seperti fenfluramina, sibutramina dan metabolitnya hanya mempunyai pertalian rendah, dan berkemungkinan afiniti yang tidak ketara terhadap reseptor 5-HT2B.[20]
Farmakokinetik
suntingSibutramina diserap dengan baik dari saluran gastrousus (77%), tetapi mengalami metabolisme laluan pertama yang ketara, mengurangkan bioketersediaannya. Ubat itu sendiri mencapai paras plasma puncaknya selepas 1 jam, dan juga mempunyai separuh hayat 1 jam. Sibutramina dimetabolismekan oleh isozim sitokrom P450, CYP3A4, kepada dua amina primer dan sekunder yang aktif farmakologi (dipanggil metabolit aktif 1 dan 2), dengan separuh hayat masing-masing ialah 14 dan 16 jam. Kepekatan plasma puncak metabolit aktif 1 dan 2 dicapai selepas tiga hingga empat jam. Laluan metabolisme berikut secara utamanya menghasilkan dua metabolit terkonjugasi dan terhidroksilasi yang tidak aktif (dipanggil metabolit 5 dan 6). Metabolit 5 dan 6 secara amnya dikumuhkan dalam air kencing.
Kimia
suntingSibutramina biasanya telah digunakan dalam bentuk garam hidroklorida monohidrat.
Pengesanan dalam cecair badan
suntingSibutramina dan dua metabolit aktif N-demetil boleh diukur dalam bendalir badan dengan kromatografi cecair-spektrometri jisim. Tahap plasma ketiga-tiga spesies ini biasanya dalam julat 1–10 μ g/L pada orang yang menjalani terapi dengan ubat tersebut. Sebatian induk dan norsibutramina selalunya tidak dapat dikesan dalam air kencing, tetapi dinorsibutramina biasanya terdapat pada kepekatan >200 μg /L.[26][27][28]
Masyarakat dan budaya
suntingKelulusan, 1997-2010
suntingSibutramina pada asalnya dibangunkan pada tahun 1988 oleh Boots di Nottingham, UK,[14] dan dipasarkan oleh Knoll Pharmaceuticals selepas BASF/Knoll AG membeli Bahagian Penyelidikan Boots pada tahun 1995. Ia diklasifikasikan sebagai bahan terkawal Jadual IV di Amerika Syarikat.
Pada tahun 1997, FDA AS meluluskannya untuk penurunan berat badan dan penyelenggaraan penurunan berat badan pada orang yang mempunyai BMI lebih besar daripada atau sama dengan 30 kg/m2 atau untuk orang yang mempunyai BMI ≥27 kg/m2 yang mempunyai faktor risiko kardiovaskular yang lain. Ia telah dikeluarkan dan dipasarkan oleh Abbott Laboratoriess.[29] Ia dijual di bawah pelbagai jenama termasuk Reductil, Meridia, Siredia dan Sibutrex.
Pada tahun 2002, kajian meneliti laporan kematian mengejut, kegagalan jantung, kegagalan buah pinggang dan masalah gastrousus. Walaupun petisyen 2002 oleh NGO Ralph Nader, Public Citizen,[30] FDA tidak membuat sebarang percubaan untuk menarik balik dadah itu, tetapi menjadi sebahagian daripada pendengaran Senat pada tahun 2005.[31] Begitu juga, pada tahun 2004, David Graham, "pemberi maklumat" FDA, memberi keterangan di hadapan Jawatankuasa Kewangan Senat yang mendengar bahawa sibutramina mungkin lebih berbahaya daripada syarat yang digunakan untuknya.[32]
Antara Januari 2003 dan November 2005, kajian besar bernama Hasil Kardiovaskular Sibrutamina (Sibutramina Cardiovascular OUTcomes, SCOUT) terkawal rawak dengan 10,742 pesakit memeriksa sama ada sibutramina diberikan dalam program pengurusan berat badan mengurangkan risiko komplikasi kardiovaskular pada orang yang berisiko tinggi terhadap penyakit jantung, dan menyimpulkan bahawa penggunaan silbutramine mempunyai RR 1.16 bagi hasil utama (komposit MI bukan maut, CVA bukan maut, serangan jantung, dan kematian CV).[33]
Pada April 2010, David Haslam (pengerusi Forum Obesiti Kebangsaan) berhujah dalam artikel "Sibutramina: hilang, tetapi tidak dilupakan", bahawa kajian SCOUT adalah cacat kerana ia hanya meliputi pesakit berisiko tinggi, dan tidak menganggap pesakit obes yang tidak mempunyai komplikasi kardiovaskular atau kontraindikasi yang serupa.[34]
Pada 21 Januari 2010, Agensi Ubat Eropah mengesyorkan penggantungan kebenaran pemasaran sibutramina berdasarkan keputusan kajian SCOUT.[35]
Pada Ogos 2010 FDA menambah kontraindikasi baharu untuk pesakit yang berumur lebih dari 65 tahun kerana kajian klinikal sibutramina tidak termasuk bilangan pesakit yang mencukupi.[15]
Pada 8 Oktober 2010, FDA mengesyorkan agar tidak meneruskan preskripsi oleh kerana risiko kardiovaskular yang tidak perlu kepada pesakit, dan meminta Abbott Laboratories untuk menarik diri secara sukarela.[29] Abbott mengumumkan pada hari yang sama bahawa ia telah menarik balik sibutramina daripada pasaran AS, memetik kebimbangan terhadap keberkesanan minimum ditambah dengan peningkatan risiko kejadian kardiovaskular yang buruk.[36]
Produk penurunan berat badan tiruan, 2008 - kini
suntingPada 22 Disember 2008, FDA mengeluarkan amaran kepada pengguna yang menamakan 27 produk berbeza yang dipasarkan sebagai "makanan tambahan" penurunan berat badan mengandungi jumlah sibutramina secara haram yang tidak didedahkan.[37][38] Pada Mac 2009, Dieter Müller et al. menerbitkan kajian kes keracunan sibutramina daripada "makanan tambahan herba" Cina yang serupa yang dijual di Eropah, mengandungi sebanyak dua kali ganda dos ubat yang dilesenkan secara sah.[39]
Tambahan 34 produk telah ditarik balik oleh FDA pada 22 April 2009, seterusnya menekankan risiko yang berkaitan dengan "suplemen herba" yang tidak terkawal kepada orang yang tidak curiga. Kebimbangan ini amat relevan kepada mereka yang mempunyai keadaan perubatan asas yang tidak serasi dengan penambah farmaseutikal yang tidak diisytiharkan. Pada Januari 2010, amaran yang sama telah dikeluarkan bagi versi palsu ubat penurunan berat badan yang dijual di kaunter Alli melalui Internet. Berbanding bahan aktif orlistat, ubat tiruan mengandungi sibutramina dalam kepekatan sekurang-kurangnya dua kali ganda jumlah yang disyorkan untuk penurunan berat badan.[40]
Pada Mac 2010, Health Canada menasihatkan orang ramai bahawa "Herbal Diet Natural" haram telah ditemui di pasaran yang mengandungi sibutramina yang dikawal Kanada tanpa menyenaraikan sibutramina sebagai ramuan.[41] Pada Oktober 2010 FDA memberitahu pengguna bahawa "Slimming Beauty Bitter Orange Slimming Capsules mengandungi bahan farmaseutikal aktif sibutramina, ubat preskripsi sahaja yang merupakan perangsang. Sibutramina tidak disenaraikan pada label produk."[42]
Dalam kajian 2018, FDA menemui bahan tambahan sintetik termasuk sibutramina dalam lebih 700 suplemen diet yang dipasarkan sebagai "semula jadi", "tradisional" atau "ubat herba".[43]
Rujukan
sunting- ^ Anvisa (2023-03-31). "RDC Nº 784 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial" [Collegiate Board Resolution No. 784 - Lists of Narcotic, Psychotropic, Precursor, and Other Substances under Special Control] (dalam bahasa Portugis). Diário Oficial da União (diterbitkan 2023-04-04). Diarkibkan daripada yang asal pada 2023-08-03. Dicapai pada 2023-08-16.
- ^ "Sibutramine (Reductil) - withdrawal in Australia". Therapeutic Goods Administration, Department of Health, Australian Government. 2010. Diarkibkan daripada yang asal pada 2014-07-03. Dicapai pada 2014-10-06.
- ^ Health Canada Endorsed Important Safety Information on MERIDIA (Sibutramine Hydrochloride Monohydrate) Diarkibkan 2013-01-11 di Wayback Machine: Subject: Voluntary withdrawal of Meridia (sibutramine) capsules from the Canadian market.
- ^ "Notification of Termination of Production, Sale, and Usage of Sibutramine Preparations and Their Active Pharmaceutical Ingredient". sda.gov in People's Republic of China. October 30, 2010. Diarkibkan daripada yang asal pada 2011-10-07. Dicapai pada 2011-05-21.
- ^ (dalam bahasa Jerman) Sibutramin-Vertrieb in der Europäischen Union ausgesetzt Diarkibkan 2012-07-19 di archive.today.
- ^ "De-registration of pharmaceutical products containing sibutramine" (Siaran akhbar). info.gov in Hong Kong. November 2, 2010. Dicapai pada 2010-11-08.
- ^ "Banned Medicines" (Siaran akhbar). Ministry of Health and Family Welfare. February 10, 2011. Dicapai pada 2011-03-15.
- ^ "Withdrawal of Sibutramine (Reductil) in New Zealand" (Siaran akhbar). MedSafe in New Zealand. October 11, 2010. Dicapai pada 2012-11-06.
- ^ "FDA warns online sellers of banned slimming pills". January 12, 2014. Diarkibkan daripada yang asal pada January 15, 2014. Dicapai pada February 20, 2014.
- ^ "Thai FDA reveals voluntary withdrawal of sibutramine from the Thai market" (PDF) (Siaran akhbar). Food and Drug Administration of Thailand. October 20, 2010. Diarkibkan daripada yang asal (PDF) pada 2011-05-11. Dicapai pada 2010-12-22.
- ^ "Top obesity drug sibutramine being suspended". BBC News. 2010-01-22. Diarkibkan daripada yang asal pada 2010-01-25. Dicapai pada 2010-01-22.
- ^ "Abbott Pulls Diet Drug Meridia Off US Shelves". The Wall Street Journal. October 8, 2010. Diarkibkan daripada yang asal pada 11 October 2010. Dicapai pada 8 October 2010.
- ^ "Sibutramine - Drugs.com". drugs.com. Diarkibkan daripada yang asal pada 2017-10-08. Dicapai pada 2017-10-08.
- ^ a b c "The pharmacology of sibutramine hydrochloride (BTS 54 524), a new antidepressant which induces rapid noradrenergic down-regulation". Progress in Neuro-Psychopharmacology & Biological Psychiatry. 12 (5): 575–584. 1988. doi:10.1016/0278-5846(88)90003-6. PMID 2851857.
- ^ a b c "The FDA August 2010 drug safety update". fda.gov. Diarkibkan daripada yang asal pada 2017-01-12. Dicapai pada 2019-12-16.
- ^ a b "Meridia (sibutramine hydrochloride): Follow-Up to an Early Communication about an Ongoing Safety Review". United States Food and Drug Administration. 1 February 2010. Diarkibkan daripada yang asal pada 6 January 2012.
- ^ "Long-term effects of weight-reducing drugs in people with hypertension". The Cochrane Database of Systematic Reviews. 1 (1): CD007654. January 2021. doi:10.1002/14651858.CD007654.pub5. PMC 8094237. PMID 33454957.
- ^ a b c "Meridia Side Effects, and Drug Interactions". RxList.com. 2007. Diarkibkan daripada yang asal pada 2008-08-09. Dicapai pada 2007-04-29.
- ^ (dalam bahasa Portugis) Cloridrato de sibutramina monoidratado.
- ^ a b "Meridia (sibutramine hydrochloride monohydrate) Capsules CIV. Full Prescribing Information" (PDF). Abbott Laboratories, North Chicago, IL 60064, U.S.A. Diarkibkan (PDF) daripada yang asal pada 17 February 2017. Dicapai pada 6 February 2016.
- ^ "Sibutramine: a novel anti-obesity drug. A review of the pharmacological evidence to differentiate it from d-amphetamine and d-fenfluramine". International Journal of Obesity and Related Metabolic Disorders. 22 (Suppl 1): S18-28, discussion S29. August 1998. PMID 9758240.
- ^ "FDA APPROVES SIBUTRAMINE TO TREAT OBESITY" (Siaran akhbar). U.S. Food and Drug Administration. November 24, 1997. Dicapai pada 2007-04-29.
- ^ "Association of CYP2B6, CYP3A5, and CYP2C19 genetic polymorphisms with sibutramine pharmacokinetics in healthy Korean subjects". Clinical Pharmacology and Therapeutics. 86 (5): 511–518. November 2009. doi:10.1038/clpt.2009.145. PMID 19693007.
- ^ Hofbauer K (2004). Pharmacotherapy of obesity : options and alternatives. Boca Raton, Fla: CRC Press. ISBN 978-0-415-30321-7.
- ^ "Enantioselective behavioral effects of sibutramine metabolites". European Journal of Pharmacology. 397 (1): 93–102. May 2000. doi:10.1016/s0014-2999(00)00216-8. PMID 10844103.
- ^ "Liquid chromatography/electrospray ionization tandem mass spectrometry validated method for the simultaneous quantification of sibutramine and its primary and secondary amine metabolites in human plasma and its application to a bioequivalence study". Rapid Communications in Mass Spectrometry. 20 (23): 3509–3521. 2006. Bibcode:2006RCMS...20.3509J. doi:10.1002/rcm.2760. PMID 17072906. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Determination of N-desmethyl- and N-bisdesmethyl metabolites of Sibutramine in doping control analysis using liquid chromatography-tandem mass spectrometry". European Journal of Mass Spectrometry. Chichester, England. 12 (2): 129–36. 2006. doi:10.1255/ejms.797. PMID 16723754.
- ^ Baselt R (2008). Disposition of Toxic Drugs and Chemicals in Man (ed. 8th). Foster City, CA: Biomedical Publications. m/s. 1426–1427.
- ^ a b Center for Drug Evaluation and Research (2019-06-28). "FDA Drug Safety Communication: FDA Recommends Against the Continued Use of Meridia (sibutramine)". FDA (dalam bahasa Inggeris). Diarkibkan daripada yang asal pada 2022-12-12. Dicapai pada 2022-12-12.
- ^ "Petition to FDA to ban the diet drug sibutramine (MERIDIA) (HRG Publication #1613)". Public Citizen. March 19, 2002. Diarkibkan daripada yang asal pada 2006-12-19. Dicapai pada 2007-04-29.
- ^ "FDA weighs decision on Meridia; Health advisory likely for Abbott obesity drug". Chicago Tribune. Chicago, Illinois. 13 March 2005. m/s. 1.
- ^ Hearing of 17 November 2004. "Insider: FDA Won't Protect Public". CBS News. 19 November 2004. Diarkibkan daripada yang asal pada 19 May 2006.
- ^ "Effect of sibutramine on cardiovascular outcomes in overweight and obese subjects" (PDF). The New England Journal of Medicine. 363 (10): 905–917. September 2010. doi:10.1056/NEJMoa1003114. PMID 20818901. Unknown parameter
|displayauthors=ignored (bantuan);|hdl-access=requires|hdl=(bantuan) - ^ "Sibutramine: gone, but not forgotten" (PDF). Pract Diab Int. 27 (3): 96–97. April 2010. doi:10.1002/pdi.1453. Diarkibkan daripada yang asal (PDF) pada 26 July 2015.
- ^ "European Medicines Agency recommends suspension of marketing authorisations for sibutramine" (PDF). European Medicines Agency. January 21, 2010. Diarkibkan daripada yang asal (PDF) pada 2010-04-01.
- ^ Andrew Pollack (October 8, 2010). "Abbott Labs Withdraws Meridia From Market". The New York Times. Diarkibkan daripada yang asal pada March 28, 2017. Dicapai pada February 25, 2017.
- ^ "FDA warns consumers about tainted weight loss pills" (Siaran akhbar). U.S. Food and Drug Administration. 22 December 2008.
- ^ "Consumer directed questions and answers about FDA's initiative against contaminated weight loss products". U.S. Food and Drug Administration Center for Drug Evaluation and Research. 22 December 2008. Diarkibkan daripada yang asal pada 17 March 2009. Dicapai pada 16 December 2019.
- ^ "Chinese slimming capsules containing sibutramine sold over the Internet: a case series". Deutsches Ärzteblatt International. 106 (13): 218–222. March 2009. doi:10.3238/arztebl.2009.0218. PMC 2680571. PMID 19471631.
- ^ "Fake Alli diet pills can pose health risks". CNN.com. January 23, 2010. Diarkibkan daripada yang asal pada 2010-01-25. Dicapai pada 2010-01-24.
- ^ "Herbal diet product poses heart risk". CBC News. March 26, 2010. Diarkibkan daripada yang asal pada March 28, 2010. Dicapai pada March 26, 2010.
- ^ "FDA Alert: Slimming Beauty Bitter Orange Slimming Capsules: Undeclared Drug Ingredient". drugs.com. Diarkibkan daripada yang asal pada 2018-08-25. Dicapai pada 2018-01-23.
- ^ "No Wonder It Works So Well: There May Be Viagra In That Herbal Supplement". NPR.org (dalam bahasa Inggeris). 12 October 2018. Diarkibkan daripada yang asal pada 2018-10-13. Dicapai pada 2018-10-14.