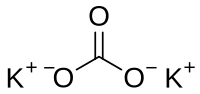
Kalium karbonat
Kalium karbonat(Formula kimia:K2CO3,Nama Inggris:Potassium carbonate), Ia adalah kristal berwarna atau zarah putih, boleh menyerap kelembapan, dan larut dalam air. Penyelesaiannya ialah alkali. Tidak boleh larut dalam alkohol dan eter. Ia boleh diperoleh dengan bertindak balas kalium hidroksida dengan karbon dioksida, dan lazimnya digunakan dalam penghasilan sabun dan kaca.[1]
| |
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Kalium karbonat
| |
| Pengecam | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.665 |
| Nombor E | E501(i) (pengawal keasidan pH & agen antikerakan) |
| Nombor RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| K2CO3 | |
| Jisim molar | 138.2055 |
| Rupa bentuk | pepejal putih yang basah |
| Ketumpatan | 2.29 g/cm3 (Pepejal) |
| Takat lebur | 891 °C |
| Takat didih | merebut |
| 112 g/100 mL (20 °C) | |
| Bahaya | |
| NFPA 704 (berlian api) | |
| Takat kilat | Tidak boleh dibakar |
| Sebatian berkaitan | |
Anion lain
|
Kalium bikarbonat |
Kation lain
|
litium karbonat, natrium karbonat, sesium karbonat |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| Rujukan kotak info | |
Penghasilan sunting
Kalium karbonat disediakan secara komersial melalui tindak balas kalium hidroksida dengan karbon dioksida:[1]
- 2 KOH + CO2 → K2CO3 + H2O
Larutan ini akan mengeluarkan hablur seskuihidrat, K2CO3·3⁄2H2O ("potasy hidrat"). Pemanasan pepejal dengan suhu lebih 200 °C (392 °F) akan memberi bentuk kontang. Dalam cara alternatif, kalium klorida dirawat dengan karbon dioksida dengan kehadiran amina organik untuk memperoleh kalium bikarbonat, dan kemudiannya mengalami pengkalsinan:
- 2 KHCO3 → K2CO3 + H2O + CO2
Rujukan sunting
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). "Potassium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.CS1 maint: uses authors parameter (link)
