Trioksidana
Trioksidana, hidrogen trioksida atau dihidrogen trioksida ialah satu molekul tidak stabil dengan formula H2O3 atau HOOOH. Ia adalah salah satu daripada polioksida hidrogen. Dalam larutan akua, trioksidana mereput dan membentuk air dan oksigen singlet:
| Nama | |
|---|---|
| Nama IUPAC
Trioxidane
| |
| Nama lain
Dihidrogen trioksida
Hidrogen trioksida Water-Air Dihidroksi eter | |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChemSpider | |
| 200290 | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| H2O3 | |
| Jisim molar | 50.01 g·mol−1 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Tindak balas berlawanannya, penambahan oksigen singlet ke dalam air, biasanya tidak berlaku kerana jarangnya oksigen singlet. Namun, dalam sistem biologi, ozon diketahui terbentuk daripada oksigen singlet, dan mekanismanya dianggap adalah penghasilan trioksidana yang dimangkin antibodi daripada oksigen singlet.[1]
Penyediaan
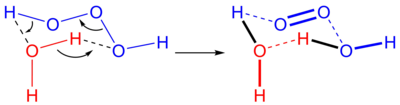
suntingTrioksidana boleh diperolehi dalam jumlah yang kecil tetapi boleh dikesan daripada tindak balas antara ozon dan hidrogen peroksida, atau melalui penceraian air menggunakan elektrik. Jumlah yang lebih besar telah disediakan melalui tindak balas antara ozon dengan agen-agen penurun organik pada suhu yang rendah di dalam pelbagai jenis pelarut organik seperti di dalam proses Anthraquinone, dan ia juga terhasil ketika pereputan hidrotrioksida organik (ROOOH).[2]
Tindak balas ozon dan hidrogen peroksida dikenali sebagai "proses Peroksona". Campuran ini pernah digunakan untuk beberapa ketika untuk merawat air bawah tanah yang dicemari oleh sebatian-sebatian organik. Tindak balas ini membentuk H2O3 dan H2O5.[3]
Struktur
suntingAnalisis spektroskopi menunjukkan bahawa molekul ini mempunyai struktrur linear pencong H-O-O-O-H, dengan panjang ikatan O-O lebih pendek daripada ikatan dalam hidrogen peroksida. Pelbagai bentuk dimerik dan trimerik juga kelihatan wujud. Ia lebih berasid sedikit daripada hidrogen peroksida dan bercerai membentuk H+ OOOH-.[4]
Tindak balas
suntingTrioksidana secara sedia mereput kepada air dan oksigen singlet, dengan separuh hayat selama 16 minit dalam pelarut organik pada suhu bilik, tetapi hanya beberapa milisaat dalam air. Ia bertindak balas dengan sulfida organik untuk membentuk sulfoksida, tetapi tidak banyak perkara lain yang diketahui tentang kereaktifannya.
Kajian terbaru menemui bahawa trioksidana ialah bahan aktif yang bertanggungjawab ke atas ciri-ciri antimikrob campuran ozon / hidrogen peroksida yang dikenali. Oleh kerana dua sebatian ini juga wujud dalam sistem-sistem biologi, dikatakan satu antibodi dalam badan manusia boleh menghasilkan trioksidana sebagai bahan pengoksidaan yang berkuasa menentang bakteria yang menyerang.[1][5] Sumber sebatian ini dalam sistem biologi ialah tindak balas antara oksigen singlet dan air (yang bermula daripada mana-mana arah dahulu, sudah tentu, mengikut kepekatan), dan oksigen singlet dihasilkan oleh sel imun.[2][6]
Pada tahun 2005, trioksidana telah diperhatikan secara uji kaji melalui spektroskopi gelombang mikro dalam jet supersonik. Molekul ini wujud dalam rentas konformasi dengan panjang ikatan oksigen-oksigen sepanjang 142.8 pikometer berbanding dengan 146.4 pikometer untuk hidrogen peroksida. Kimia pengiraan meramalkan bahawa banyak molekul rantai oksigen atau polioksida hidrogen wujud, malahan rantaian oksigen tak terhingga boleh terbentuk dalam gas bersuhu rendah. Dengan bukti spektroskopi ini, satu pencarian untuk molekul jenis ini boleh bermula di ruang antara najam.[4]
Rujukan
sunting- ^ a b Paul T. Nyffeler, Nicholas A. Boyle, Laxman Eltepu, Chi-Huey Wong, Albert Eschenmoser, Richard A. Lerner, Paul Wentworth Jr. (2004). "Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone". Angewandte Chemie International Edition. 43 (35): 4656–4659. doi:10.1002/anie.200460457. PMID 15317003.CS1 maint: multiple names: authors list (link)
- ^ a b Božo Plesničar (2005). "Progress in the Chemistry of Dihydrogen Trioxide (HOOOH)" (PDF). Acta Chim. Slov. 52: 1–12. Dicapai pada 23 April 2012.[pautan mati kekal]
- ^ Xin Xu dan William A. Goddard III. Peroxonechemistry:Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2
- ^ a b Kohsuke Suma, Yoshihiro Sumiyoshi, dan Yasuki Endo (2005). "The Rotational Spectrum and Structure of HOOOH". J. Am. Chem. Soc. 127 (43): 14998–14999. doi:10.1021/ja0556530. PMID 16248618. Diarkibkan daripada yang asal pada 2013-05-23. Dicapai pada 2021-08-13.CS1 maint: multiple names: authors list (link)
- ^ A Time-Honored Chemical Reaction Generates an Unexpected Product, News & Views, September 13, 2004
- ^ Roald Hoffmann (2004). "The Story of O". American Scientist. doi:10.1511/2004.1.23.