Benzena
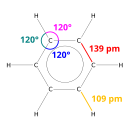
Benzena adalah sejenis bahan kimia organik penting dengan formula kimia C6H6. Molekul ini terdiri daripada 6 atom karbon menyertai dalam gelang, dengan 1 atom hidrogen yang melekat pada setiap atom karbon. Kerana molekul ini mengandungi hanya atom karbon dan hidrogen, benzena dikelaskan sebagai hidrokarbon.Benzena adalah satu juzuk semulajadi minyak mentah, dan merupakan salah satu daripada petrokimia yang paling asas. Benzena adalah hidrokarbon aromatik dan yang kedua [n]-annulene ([6]-annulene), hidrokarbon siklik dengan ikatan pi yang berterusan. Ia kadang-kadang disingkatkan sebagai Ph-H. Benzena adalah cecair tidak berwarna dan sangat mudah terbakar dengan bau manis. Ia digunakan terutamanya sebagai pelopor kepada bahan kimia yang berat, seperti etilbenzena dan kumena, yang dihasilkan pada skala bilion kilogram. Kerana ia mempunyai nombor oktana yang tinggi, ia adalah satu komponen penting dalam petrol, yang terdiri daripada beberapa peratus daripada jisimnya. Kebanyakan aplikasi bukan perindustrian telah dihadkan kerana sifat karsinogen benzena.
| |||
 Molekul benzena
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Benzena
| |||
| Nama IUPAC sistematik
Sikloheksa-1,3,5-triena | |||
| Nama lain
1,3,5-Sikloheksatriena, Benzol, Fenil hidrida
| |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.685 | ||
| Nombor EC |
| ||
| KEGG | |||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C6H6 | |||
| Jisim molar | 78.11 g·mol−1 | ||
| Rupa bentuk | Cecair tidak berwarna | ||
| Bau | Beraroma, seperti petrol | ||
| Ketumpatan | 0.8765(20) g/cm3[1] | ||
| Takat lebur | 5.53 °C (41.95 °F; 278.68 K) | ||
| Takat didih | 80.1 °C (176.2 °F; 353.2 K) | ||
| 1.53 g/L (0 °C) 1.81 g/L (9 °C) 1.79 g/L (15 °C)[2][3][4] 1.84 g/L (30 °C) 2.26 g/L (61 °C) 3.94 g/L (100 °C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[5] | |||
| Keterlarutan | Larut dalam alkohol, CHCl3, CCl4, dietil eter, aseton, asid asetik[5] | ||
| Keterlarutan dalam etanadiol | 5.83 g/100 g (20 °C) 6.61 g/100 g (40 °C) 7.61 g/100 g (60 °C)[5] | ||
| Keterlarutan dalam etanol | 20 °C, larutan dalam air: 1.2 mL/L (20% v/v)[6] | ||
| Keterlarutan dalam aseton | 20 °C, larutan dalam air: 7.69 mL/L (38.46% v/v) 49.4 mL/L (62.5% v/v)[6] | ||
| Keterlarutan dalam dietilena glikol | 52 g/100 g (20 °C)[5] | ||
| log P | 2.13 | ||
| Tekanan wap | 12.7 kPa (25 °C) 24.4 kPa (40 °C) 181 kPa (100 °C)[7] | ||
| UV-vis (λmax) | 255 nm | ||
| 54.8·10−6 cm3/mol | |||
Indeks biasan (nD)
|
1.5011 (20 °C) 1.4948 (30 °C)[5] | ||
| Kelikatan | 0.7528 cP (10 °C) 0.6076 cP (25 °C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) | ||
| Struktur | |||
| Bentuk molekul | molekul bersatah trigon | ||
| Momen dwikutub | 0 D | ||
| Termokimia | |||
| Muatan haba tentu, C | 134.8 J/mol·K | ||
| Entropi molar piawai S |
173.26 J/mol·K[7] | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
48.7 kJ/mol | ||
Entalpi pembakaran
piawai (ΔcH⦵298) |
3267.6 kJ/mol[7] | ||
| Bahaya | |||
| Bahaya-bahaya utama | karsinogen pekerjaan yang berpotensi, mudah terbakar | ||
| Piktogram GHS |    [8] [8]
| ||
| Perkataan isyarat GHS | Berbahaya | ||
| H225, H304, H315, H319, H340, H350, H372[8] | |||
| P201, P210, P301+310, P305+351+338, P308+313, P331[8] | |||
| NFPA 704 (berlian api) | |||
| Takat kilat | −11.63 °C (11.07 °F; 261.52 K) | ||
| 497.78 °C (928.00 °F; 770.93 K) | |||
| Had letupan | 1.2–7.8% | ||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LD50 (median dos)
|
930 mg/kg (tikus, mulut) | ||
LCLo (paling rendah diketahui)
|
44,000 ppm (rabbit, 30 min) 44,923 ppm (dog) 52,308 ppm (cat) 20,000 ppm (human, 5 min)[10] | ||
| NIOSH (Had pendedahan kesihatan AS): | |||
PEL (Dibenarkan)
|
TWA 1 ppm, ST 5 ppm[9] | ||
REL (Disyorkan)
|
Ca TWA 0.1 ppm ST 1 ppm[9] | ||
IDLH (Bahaya serta-merta)
|
500 ppm[9] | ||
| Sebatian berkaitan | |||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Sejarah sunting
Penemuan sunting
Perkataan "benzena" berasal sejarah daripada "gusi benzoin" (resin benzoin), resin aromatik diketahui ahli farmasi Eropah dan minyak wangi sejak abad ke-15 sebagai produk Asia Tenggara. Bahan berasid adalah daripada benzoin oleh pemejalwapan, dan dinamakan "bunga benzoin", atau asid benzoik. Hidrokarbon yang diperolehi daripada asid benzoik dengan itu memperolehi nama benzin, benzol, atau benzena. Michael Faraday pertama kali mengasingkan dan mengenal pasti benzena pada tahun 1825 daripada sisa berminyak yang diperolehi daripada pengeluaran gas menerangi, memberikan bicarburet nama hidrogen. Pada tahun 1833, Eilhard Mitscherlich menghasilkannya melalui penyulingan asid benzoik (dari gusi benzoin) dan kapur. Dia memberikan kompaun benzin nama. Pada tahun 1836, ahli kimia Perancis Auguste Laurent bernama bahan "phène"; ini adalah punca daripada fenol perkataan, yang hydroxylated benzena, dan fenil, yang merupakan radikal dibentuk oleh abstraksi atom hidrogen ( H radikal bebas • ) daripada benzena.Pada tahun 1845, Charles Mansfield, bekerja di bawah Ogos Wilhelm von Hofmann, benzena diasingkan daripada tar arang batu. Empat tahun kemudian, Mansfield memulakan pengeluaran berskala industri pertama benzena, berdasarkan kaedah arang batu tar. Secara beransur-ansur erti kata yang berkembang di kalangan ahli kimia bahawa bahan-bahan yang berkaitan dengan benzena mewakili keluarga kimia yang pelbagai. Pada tahun 1855, Hofmann menggunakan perkataan "aromatik" untuk menetapkan hubungan kekeluargaan ini, selepas sebuah hartanah ciri banyak ahli-ahlinya. Pada tahun 1997, benzena dikesan dalam ruang yang mendalam .
Formula Cincin sunting
Formula empirik bagi benzena telah lama diketahui, tetapi strukturnya sangat politaktepu, dengan hanya satu atom hidrogen untuk setiap atom karbon, amat mencabar untuk menentukan. Archibald Scott Couper pada tahun 1858 dan Yusuf Loschmidt pada tahun 1861 mencadangkan struktur yang terkandung bon berganda dua atau cincin berganda, tetapi terlalu sedikit bukti ketika itu bersedia untuk membantu ahli kimia membuat keputusan mengenai apa-apa struktur tertentu.
Pada tahun 1865, ahli kimia Jerman, Friedrich Ogos Kekulé menerbitkan kertas kerja dalam Bahasa Perancis (untuk beliau kemudian mengajar di bertutur bahasa Perancis Belgium) menunjukkan bahawa struktur yang terkandung cincin enam ahli atom karbon dengan berselang-seli ikatan tunggal dan berganda. Pada tahun berikutnya , beliau menerbitkan kertas yang lebih lama di Jerman mengenai perkara yang sama . Kekulé digunakan bukti yang telah terkumpul di dalam tahun - iaitu campur tangan , yang sentiasa ada kelihatan hanya satu isomer mana-mana monoderivative benzena , dan bahawa terdapat sentiasa kelihatan betul-betul tiga isomer setiap terbitan -kini disubstituted difahami sesuai dengan orto , corak meta, dan para of Arene penggantian - untuk berhujah bagi menyokong struktur yang dicadangkan itu . Cincin simetri Kekulé ini boleh menjelaskan fakta-fakta yang ingin tahu , dan juga 1 benzena : 1 nisbah karbon- hidrogen.
Pemahaman baru benzena, dan dengan itu semua sebatian aromatik, terbukti menjadi begitu penting untuk kedua-dua tulen dan kimia gunaan yang pada tahun 1890 Jerman Persatuan Kimia menganjurkan penghargaan rumit penghormatan Kekulé ini, meraikan ulang tahun kedua puluh lima kertas benzena pertamanya . Di sini Kekulé bercakap mengenai penciptaan teori. Beliau berkata bahawa dia telah menjumpai bentuk cincin molekul benzena selepas mempunyai angan-angan atau hari-mimpi ular menyita ekor sendiri (ini adalah simbol yang sama dalam banyak kebudayaan purba yang dikenali sebagai Ouroboros atau simpulan Endless). Visi ini, beliau berkata, datang kepadanya selepas tahun belajar sifat ikatan karbon-karbon. Ini adalah 7 tahun, setelah ia berjaya menyelesaikan masalah bagaimana atom karbon boleh bon untuk sehingga empat atom lain pada masa yang sama. Adalah menghairankan bahawa, gambaran lucu yang sama benzena telah muncul pada tahun 1886 di der Berichte Durstigen Chemischen Gesellschaft (Jurnal Dahaga Persatuan Kimia), parodi der Berichte Deutschen Chemischen Gesellschaft, hanya parodi mempunyai monyet merampas satu sama lain dalam bulatan, daripada ular seperti dalam anekdot Kekulé ini. Sesetengah ahli sejarah telah mencadangkan bahawa parodi itu adalah tulisan ejekan anekdot ular, mungkin sudah terkenal secara lisan walaupun ia belum lagi muncul dalam media cetak. (Sebahagian yang lain telah membuat spekulasi bahawa cerita Kekulé ini pada tahun 1890 adalah parodi semula spoof monyet, dan merupakan ciptaan semata-mata dan bukan ingatan sesuatu peristiwa dalam hidupnya. [Rujukan?]) Kekulé ini 1890 pertuturan di mana anekdot ini muncul mempunyai telah diterjemahkan ke dalam bahasa Inggeris. Jika anekdot adalah ingatan daripada peristiwa sebenar, keadaan yang disebut dalam cerita menunjukkan bahawa ia mesti berlaku pada awal 1862.
Sifat kitaran benzena akhirnya disahkan oleh crystallographer Kathleen Lonsdale pada tahun 1929.
Tatanama sunting
Penggunaan pertama awalan ortho-, meta, ayat untuk membezakan derivatif benzena di- ganti adalah oleh ahli kimia Jerman Wilhelm Körner pada tahun 1867. Bagaimanapun, beliau tidak menggunakan awalan untuk membezakan kedudukan relatif gantian pada gelang benzena. Ia adalah ahli kimia Jerman Karl Grabe yang, pada tahun 1869, pertama kali digunakan awalan ortho- , meta, ayat untuk menunjukkan lokasi relatif khusus gantian pada gelang aromatik di- ganti (iaitu , naftalena). Pada tahun 1870, ahli kimia Jerman Viktor Meyer mula digunakan tatanama Grabe untuk benzena.[11]
References sunting
- ^ Templat:RubberBible86th
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). "Solubility of Benzene in Water". Industrial & Engineering Chemistry Chemical & Engineering Data Series. 3 (2): 253–256. doi:10.1021/i460004a016.
- ^ Breslow, R.; Guo, T. (1990). "Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers". Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 167–9. Bibcode:1990PNAS...87..167B. doi:10.1073/pnas.87.1.167. PMC 53221. PMID 2153285.
- ^ Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. m/s. 114. ISBN 0-7506-7766-X. Dicapai pada 2012-05-31.
- ^ a b c d e http://chemister.ru/Database/properties-en.php?dbid=1&id=644
- ^ a b Seidell, Atherton; Linke, William F. (1952). [Google Books Solubilities of Inorganic and Organic Compounds] Check
|url=value (bantuan). Van Nostrand. Dicapai pada 2014-05-29. - ^ a b c Benzene dalam Linstrom, Peter J.; Mallard, William G. (penyunting); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (dicapai pada 2014-05-29)
- ^ a b c Sigma-Aldrich Co., Benzene. Retrieved on 2014-05-29.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0049" (dalam bahasa Inggeris). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Benzene". Immediately Dangerous to Life or Health Concentrations (IDLH). Institut Kebangsaan untuk Keselamatan dan Kesihatan Pekerjaan (NIOSH).
- ^ Victor Meyer (1870) "Untersuchungen über die Constitution der zweifach-substituirten Benzole" (Investigations into the structure of di-substituted benzenes), Annalen der Chemie und Pharmacie, 156 : 265-301 ; see especially pp. 299-300.