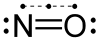Nitrik oksida
Nitrik oksida (nitrogen oksida[3] atau nitrogen monoksida) merupakan sebatian kimia gas dengan formula kimia NO dan merupakan salah satu daripada oksida-oksida nitrogen. Sebatian ini juga merupakan radikal bebas dan boleh diwakili dengan formula kimia ·NO.

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Nitrogen monoksida
| |||
| Nama IUPAC sistematik
Oksidonitrogen(•)[1] | |||
| Nama lain
Nitrogen(II) oksida
| |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3DMet | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.030.233 | ||
| Nombor EC |
| ||
| 451 | |||
| KEGG | |||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
| Nombor PBB | 1660 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| NO | |||
| Jisim molar | 30.01 g·mol−1 | ||
| Rupa bentuk | Gas tidak berwarna | ||
| Ketumpatan | 1.3402 g dm−3 | ||
| Takat lebur | −164 °C (−263 °F; 109 K) | ||
| Takat didih | −152 °C (−242 °F; 121 K) | ||
| 0.0098 g/100ml (0 °C) 0.0056 g/100ml (20 °C) | |||
Indeks biasan (nD)
|
1.0002697 | ||
| Struktur | |||
| Bentuk molekul | Linear (C∞v) | ||
| Termokimia | |||
| Entropi molar piawai S |
210.76 J K−1 mol−1 | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
91.29 kJ mol−1 | ||
| Bahaya | |||
| MSDS | External MSDS | ||
| Pengelasan EU | {{{value}}} | ||
| Frasa R | Templat:R8, Templat:R23, Templat:R34, R44 | ||
| Frasa S | Templat:S1, Templat:S17, Templat:S23, S36/37/39, S45 | ||
| NFPA 704 (berlian api) | |||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LC50 (median kepekatan)
|
315 ppm (arnab, 15 min) 854 ppm (tikus, 4 hr)[2] | ||
LCLo (paling rendah diketahui)
|
320 ppm (tikus)[2] | ||
| Sebatian berkaitan | |||
Oksida nitrogen berkaitan
|
Dinitrogen pentoksida Dinitrogen tetroksida | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Nitrik oksida boleh terhasil melalui kilat dalam ribut petir dan dalam proses pembakaran. Selain itu, nitrik oksida merupakan molekul pengisyaratan dalam proses fisiologi dan patologi mamalia, termasuk manusia.[4]
Penghasilan
suntingDalam bidang komersial, nitrik oksida boleh dihasilkan melalui proses pengoksidaan ammonia dengan platinum sebagai mangkin pada suhu 750–900 °C (biasanya pada 850°C).
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
Dalam makmal pula, nitrik oksida boleh dihasilkan dengan mudah melalui proses penurunan asid nitrik dengan kuprum.
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
Rujukan
sunting- ^ "Nitric Oxide (CHEBI:16480)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ^ a b "Nitric oxide". Immediately Dangerous to Life or Health Concentrations (IDLH). Institut Kebangsaan untuk Keselamatan dan Kesihatan Pekerjaan (NIOSH).
- ^ Hou, YC; Janczuk, A; Wang, PG (1999). "Current trends in the development of nitric oxide donors". Current Pharmaceutical Design. 5 (6): 417–41. PMID 10390607.