Porfirin
Porfirin ialah sekumpulan sebatian organik kitaran makro heterosiklik, terdiri daripada empat subunit pirol diubah suai yang saling bersambung di atom karbon α-nya melalui jambatan metina (=CH−). Dalam vertebrat, ahli penting kumpulan porfirin ialah hem yang merupakan komponen hemoprotein, dengan fungsinya termasuk membawa oksigen dalam aliran darah. Dalam tumbuhan, terbitan porfirin penting ialah klorofil yang terlibat dalam penuaian cahaya dan pemindahan elektron dalam fotosintesis.
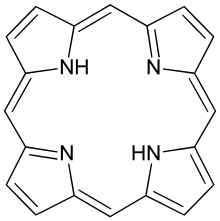
Induk porfirin ialah porfina, sebatian kimia langka yang mempunyai kepentingan teori secara khusus. Porfina yang terganti dipanggil sebagai porfirin.[1] Dengan sejumlah 26 π-elektron, di mana 18 π-elektron membentuk kitaran satah berterusan, struktur cincin porfirin sering digambarkan sebagai aromatik.[2][3] Satu hasil daripada sistem konjugasi besar ialah porfirin lazimnya menyerap dengan kuat di kawasan spektrum elektromagnet tampak, yakni berwarna gelap. Nama "porphyrin" berasal daripada perkataan Yunani πορφύρα (porphyra), bermaksud "ungu".[4]
Struktur sunting
Kompleks porfirin terdiri daripada teras MN4 segi empat sama rata. Pinggiran porfirin yang terdiri daripada karbon terhibrid sp2 secara amnya memaparkan sisihan kecil daripada kerataan. Porfirin "Ruffled" atau berbentuk pelana dikaitkan dengan interaksi sistem dengan persekitarannya.[5] Selain itu, logam selalunya tidak berpusat pada satah N4.[6] Bagi porfirin bebas, kedua-dua proton pirol adalah saling trans dan mengunjur keluar dari satah N4.[7] Herotan bukan rata ini dikaitkan dengan sifat kimia dan fizikal yang diubah. Cincin klorofil tidak rata secara jelas, tetapi lebih tepu daripada porfirin.[8]
Kompleks porfirin sunting
Seiring dengan anjakan dua proton N-H, porfirin mengikat ion logam dalam "poket" N4. Ion logam biasanya mempunyai cas 2+ atau 3+. Persamaan skematik untuk sintesis ini diwakili seperti berikut:
- H2-porfirin + [MLn]2+ → M(porfirinat)Ln−4 + 4 L + 2H+, di mana M = ion logam dan L = ligan
- Porfirin dan terbitan contoh
-
Terbitan protoporfirin IXadalah biasa dalam alam semula jadi, termasuk pelopor hem.
-
Oktaetilporfirin (H2OEP) ialah analog sintetik protoporfirin IX. Tidak seperti ligan porfirin semula jadi, OEP2− sangat simetri.
-
Tetrafenilporfirin (H2TPP) ialah satu lagi analog sintetik protoporfirin IX. Tidak seperti ligan porfirin semulajadi, TPP2− sangat simetri. Perbezaan lain ialah pusat metinanya diduduki oleh kumpulan fenil.
-
Pandangan ringkas hem, kompleks protoporfirin IX.
-
Kitaran makro 40 molekul porfirin, model
-
Kitaran makro 40 molekul porfirin, imej STM
Porfirin purba sunting
Geoporfirin, juga dikenali sebagai petroporfirin, ialah porfirin asal geologi.[9] Ia boleh berlaku dalam minyak mentah, syal minyak, arang batu atau batu enapan.[9][10] Abelsonit mungkin satu-satunya mineral geoporfirin kerana porfirin jarang wujud secara terasing dan membentuk kristal.[11]
Bidang geokimia organik berasal dari pengasingan porfirin daripada petroleum.[perlu rujukan] Penemuan ini membantu menubuhkan asal-usul biologi petroleum. Petroleum kadangkala "dicap jari" melalui analisis jumlah surih nikel dan porfirin vanadil.[perlu rujukan]
Biosintesis sunting
Dalam eukariot bukan fotosintesis seperti haiwan, serangga, kulat, dan protozoa serta kumpulan bakteria α-proteobakteria, langkah komited biosintesis porfirin ialah pembentukan asid δ-aminolevulinik (δ-ALA, 5-ALA atau dALA) melalui tindak balas asid amino glisina dengan suksinil-KoA daripada kitaran asid sitrik. Dalam tumbuhan, alga, bakteria (kecuali kumpulan α-proteobakteria) dan arkea, ia dihasilkan daripada asid glutamik melalui glutamil-tRNA dan glutamat-1-semialdehid. Enzim yang terlibat dalam laluan ini ialah glutamil-tRNA sintetase, glutamil-tRNA reduktase, dan glutamat-1-semialdehid 2,1-aminomutase. Laluan ini dikenali sebagai laluan C5 atau Beale.
Dua molekul dALA kemudiannya digabungkan oleh porfobilinogen synthase untuk memberikan porfobilinogen (PBG) yang mengandungi cincin pirol. Empat PBG kemudiannya digabungkan melalui deaminasi menjadi hidroksimetil bilana (HMB) yang dihidrolisiskan untuk membentuk gelang tetrapirol, uroporfirinogen III. Molekul ini mengalami beberapa pengubahsuaian selanjutnya. Perantaraan digunakan dalam spesies yang berbeza untuk membentuk bahan tertentu, tetapi pada manusia, protoporfirin IX selaku produk akhir utama digabungkan dengan ion besi untuk membentuk hem. Pigmen hempedu ialah produk pecahan hem.
Skim berikut meringkaskan biosintesis porfirin, dengan rujukan mengikut nombor EC dan pangkalan data OMIM. Porfiria yang dikaitkan dengan kekurangan setiap enzim juga ditunjukkan:
Sintesis makmal sunting
Sintesis biasa untuk porfirin ialah tindak balas Rothemund yang dilaporkan pertama kali pada 1936,[12][13] dan merupakan asas untuk kaedah lebih terkini oleh Adler dan Longo.[14] Huraian umum ialah proses pemeluwapan dan pengoksidaan bermula dengan pirol dan aldehid.
Kegunaanberpotensi sunting
Terapi fotodinamik sunting
Porfirin telah dinilai dalam konteks terapi fotodinamik (PDT) kerana ia menyerap cahaya dengan kuat lalu ditukar kepada haba di kawasan yang diterangi.[15] Teknik ini telah digunakan dalam pereputan makular menggunakan verteporfin.[16]
PDT dianggap sebagai rawatan kanser tak invasif yang melibatkan interaksi antara cahaya dengan frekuensi yang ditentukan, pemeka cahaya dan oksigen. Interaksi ini menghasilkan pembentukan spesies oksigen yang sangat reaktif (ROS), biasanya oksigen singlet serta anion superoksida, radikal hidroksil bebas atau hidrogen peroksida.[17] Spesies oksigen reaktif tinggi ini bertindak balas dengan biomolekul organik sel yang mudah terdedah seperti lipid, asid amino aromatik dan bes heterosiklik asid nukleik untuk menghasilkan radikal oksidatif yang merosakkan sel, dan mungkin mendorong apoptosis atau nekrosis.[18]
Elektronik dan penderia molekul sunting
Sebatian berasaskan porfirin adalah menarik sebagai komponen berpotensi dalam elektronik molekul dan fotonik.[19] Pewarna porfirin sintetik telah digabungkan dalam prototaip sel suria peka pewarna.[20][21]
Aplikasi biologi sunting
Porfirin telah disiasat sebagai agen antiradang berpotensi[22] dan dinilai daripada aspek aktiviti antikanser dan antioksidannya.[23] Beberapa konjugat porfirin-peptida didapati mempunyai aktiviti antivirus terhadap HIV secara in vitro.[24]
Toksikologi sunting
Biosintesis hem digunakan sebagai biopenanda dalam kajian toksikologi alam sekitar. Ketika pengeluaran porfirin berlebihan menunjukkan pendedahan organoklorin, plumbum pula merencatkan enzim ALA dehidratase.[25]
-
Struktur Lewis meso-tetrafenilporfirin
-
Bacaan UV-tampak meso-tetrafenilporfirin
-
Porfirin diaktifkan cahaya, oksigen monoatomik dalam penuaan sel
Spesies berkaitan sunting
Semula jadi sunting
Beberapa sebatian heterosiklik berkaitan dengan porfirin ditemui dalam alam semula jadi, dan hampir selalu terikat dengan ion logam.
| Kitaran makro N4 | Nama kofaktor | Logam | Huraian |
|---|---|---|---|
| klorin | klorofil | magnesium | Beberapa versi klorofil wujud (rantai sisi; pengecualian klorofil c) |
| bakterioklorin | bakterioklorofil (sebahagian) | magnesium | Beberapa versi bakterioklorofil wujud (rantai sisi; ada yang menggunakan cincin klorin biasa) |
| sirohidroklorin (isobakterioklorin) | sirohem | besi | Kofaktor penting dalam asimilasi sulfur |
| Perantaraan biosintetik dalam laluan ke kofaktor F430 dan B12 | |||
| korin | vitamin B12 | kobalt | Beberapa varian B12 wujud (chain sisi) |
| korfin | Kofaktor F430 | nikel | Kitaran makro dengan penurunan ketara |
Sintetik sunting
Benzoporfirin ialah porfirin dengan cincin benzena yang bercantum kepada salah satu unit pirol. Satu contoh ialah verteporfin, satu terbitan benzoporfirin.[26]
Isomer porfirin sintetik pertama telah dilaporkan oleh Emanual Vogel dan rakan sekerjanya pada 1986.[27] Isomer [18]porfirin-(2.0.2.0) ini dinamakan sebagai porfisena, dan rongga N4 tengah membentuk bentuk segi empat tepat seperti yang ditunjukkan dalam rajah.[28] Porfisena menunjukkan tingkah laku fotofizik yang menarik dan mendapati sebatian serba boleh terhadap terapi fotodinamik.[29] Ini memberi inspirasi kepada Vogel dan Sessler untuk menyahut cabaran menyediakan [18]porfirin-(2.1.0.1) dan menamakannya sebagai korfisena atau porfiserin.[30] Porfirin ketiga iaitu [18]porfirin-(2.1.1.0), telah dilaporkan oleh Callot dan Vogel-Sessler. Vogel dan rakan sekerja melaporkan kejayaan pengasingan [18]porphyrin-(3.0.1.0) atau isoporfisena.[31] Saintis Jepun Furuta[32] dan saintis Poland Latos-Grażyński[33] hampir serentak melaporkan porfirin terkeliru N. Penyongsangan salah satu subunit pirolik dalam cincin makrosiklik menghasilkan salah satu atom nitrogen yang menghadap ke luar dari teras kitaran makro.
Rujukan sunting
- ^ "Catalytic activity of multi-wall carbon nanotube supported manganese (III) porphyrin: an efficient, selective and reusable catalyst for oxidation of alkenes and alkanes with urea–hydrogen peroxide". Journal of Experimental Nanoscience. 11 (11): 872. 2016. Bibcode:2016JENan..11..872R. doi:10.1080/17458080.2016.1179802.
- ^ "Deciphering aromaticity in porphyrinoids via adaptive natural density partitioning". Organic & Biomolecular Chemistry. 12 (32): 6145–6150. August 2014. doi:10.1039/C4OB01018C. PMID 25002069.
- ^ "Origin of aromatic character in porphyrinoid systems". Journal of Porphyrins and Phthalocyanines. 15 (11n12): 1093–1115. 2011. doi:10.1142/S1088424611004063.
- ^ "porphyria (n.)". The Online Etymology Dictionary. Dicapai pada 14 September 2014.
- ^ "Conformational control of cofactors in nature - the influence of protein-induced macrocycle distortion on the biological function of tetrapyrroles". Chemical Communications. 51 (96): 17031–17063. December 2015. doi:10.1039/C5CC06254C. PMID 26482230.
|hdl-access=requires|hdl=(bantuan) - ^ Walker FA, Simonis U (2011). "Iron Porphyrin Chemistry". Encyclopedia of Inorganic and Bioinorganic Chemistry. doi:10.1002/9781119951438.eibc0104. ISBN 9781119951438.
- ^ "Conservation of the conformation of the porphyrin macrocycle in hemoproteins". Biophysical Journal. 74 (2 Pt 1): 753–763. February 1998. Bibcode:1998BpJ....74..753J. doi:10.1016/S0006-3495(98)74000-7. PMC 1302556. PMID 9533688.
- ^ "Chlorophylls, Symmetry, Chirality, and Photosynthesis". Symmetry. 6 (3): 781–843. 2014. Bibcode:2014Symm....6..781S. doi:10.3390/sym6030781.
|hdl-access=requires|hdl=(bantuan) - ^ a b Kadish KM, penyunting (1999). The Porphyrin Handbook. Elsevier. m/s. 381. ISBN 9780123932006.
- ^ "Total synthesis of the porphyrin mineral abelsonite and related petroporphyrins with five-membered exocyclic rings". Tetrahedron Letters. 44 (39): 7253. September 2003. doi:10.1016/j.tetlet.2003.08.007.
- ^ "Review of the stratigraphic distribution and diagenetic history of abelsonite". Organic Geochemistry. 14 (6): 585. 1989. Bibcode:1989OrGeo..14..585M. doi:10.1016/0146-6380(89)90038-7.
- ^ "A New Porphyrin Synthesis. The Synthesis of Porphin". J. Am. Chem. Soc. 58 (4): 625–627. 1936. doi:10.1021/ja01295a027.
- ^ "Formation of Porphyrins from Pyrrole and Aldehydes". J. Am. Chem. Soc. 57 (10): 2010–2011. 1935. doi:10.1021/ja01313a510.
- ^ "A simplified synthesis for meso-tetraphenylporphine". J. Org. Chem. 32 (2): 476. 1967. doi:10.1021/jo01288a053.
- ^ "Porphyrin conjugates for cancer therapy". Handbook of Porphyrin Science. 27. 2014. m/s. 303–416.
- ^ "Photodynamic therapy for neovascular age-related macular degeneration" (PDF). The Cochrane Database of Systematic Reviews (3): CD002030. July 2007. doi:10.1002/14651858.CD002030.pub3. PMID 17636693.
- ^ "A role for hydrogen peroxide in the pro-apoptotic effects of photodynamic therapy". Photochemistry and Photobiology. 85 (6): 1491–1496. 2009. doi:10.1111/j.1751-1097.2009.00589.x. PMC 2783742. PMID 19659920.
- ^ "Glycosylated Porphyrins, Phthalocyanines, and Other Porphyrinoids for Diagnostics and Therapeutics". Chemical Reviews. 115 (18): 10261–10306. September 2015. doi:10.1021/acs.chemrev.5b00244. PMC 6011754. PMID 26317756.
- ^ "Synthesis of π-extended porphyrins via intramolecular oxidative coupling". Chemical Communications. 48 (81): 10069–10086. October 2012. doi:10.1039/c2cc31279d. PMID 22649792.
- ^ "Porphyrins and phthalocyanines in solar photovoltaic cells". Journal of Porphyrins and Phthalocyanines. 14 (9): 759–792. 2010. doi:10.1142/S1088424610002689.
- ^ "Porphyrin-sensitized solar cells with cobalt (II/III)-based redox electrolyte exceed 12 percent efficiency". Science. 334 (6056): 629–634. November 2011. Bibcode:2011Sci...334..629Y. doi:10.1126/science.1209688. PMID 22053043. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Synthesis, antinociceptive and anti-inflammatory effects of porphyrins". Bioorganic & Medicinal Chemistry. 23 (10): 2529–2537. May 2015. doi:10.1016/j.bmc.2015.03.043. PMID 25863493.
- ^ "Synthesis and bioactivity of oxovanadium(IV)tetra(4-methoxyphenyl)porphyrinsalicylates". BMC Chemistry. 13 (1): 15. December 2019. doi:10.1186/s13065-019-0523-9. PMC 6661832. PMID 31384764.
- ^ "Penetrating the Blood-Brain Barrier with New Peptide-Porphyrin Conjugates Having anti-HIV Activity". Bioconjugate Chemistry. 32 (6): 1067–1077. June 2021. doi:10.1021/acs.bioconjchem.1c00123. PMC 8485325 Check
|pmc=value (bantuan). PMID 34033716. Unknown parameter|displayauthors=ignored (bantuan) - ^ Walker CH, Silby RM, Hopkin SP, Peakall DB (2012). Principles of Ecotoxicology. Boca Raton, FL: CRC Press. m/s. 182. ISBN 978-1-4665-0260-4.
- ^ "Verteporfin". Drugs & Aging. 16 (2): 139–146, discussion 146–8. February 2000. doi:10.2165/00002512-200016020-00005. PMID 10755329.
- ^ "Porphycene—a Novel Porphin Isomer". Angewandte Chemie. 25 (3): 257. March 1986. doi:10.1002/anie.198602571.
- ^ "3,6,13,16-Tetrapropylporphycene: Rational Synthesis, Complexation, and Halogenation". The Journal of Organic Chemistry. 87 (5): 2721–2729. March 2022. doi:10.1021/acs.joc.1c02652. PMID 35061396 Check
|pmid=value (bantuan). - ^ "Basic principles of photodynamic therapy". Journal of Porphyrins and Phthalocyanines. 5 (2): 105. 2001. doi:10.1002/jpp.328.
- ^ "New Porphycene Ligands: Octaethyl‐ and Etioporphycene (OEPc and EtioPc)—Tetra‐ and Pentacoordinated Zinc Complexes of OEPc". Angewandte Chemie International Edition. 32 (11): 1600. November 1993. doi:10.1002/anie.199316001.
- ^ "Isoporphycene: The Fourth Constitutional Isomer of Porphyrin with an N(4) Core-Occurrence of E/Z Isomerism". Angewandte Chemie. 38 (19): 2919–2923. October 1999. doi:10.1002/(SICI)1521-3773(19991004)38:19<2919::AID-ANIE2919>3.0.CO;2-W. PMID 10540393. Unknown parameter
|displayauthors=ignored (bantuan) - ^ ""N-Confused Porphyrin": A New Isomer of Tetraphenylporphyrin". J. Am. Chem. Soc. 116 (2): 767. 1994. doi:10.1021/ja00081a047.
- ^ "Tetra‐p‐tolylporphyrin with an Inverted Pyrrole Ring: A Novel Isomer of Porphyrin". Angewandte Chemie International Edition. 33 (7): 779. 18 April 1994. doi:10.1002/anie.199407791.