Asid tartarik
Asid tartarik ialah sebuah asid organik yang berwarna putih dan muncul dalam bentuk kristal yang terdapat secara semula jadi dalam banyak buah-buahan, terutamanya dalam buah anggur, tetapi juga dalam pisang, asam jawa, dan sitrus.[3] Garamnya, kalium bitartrat, biasanya dikenali sebagai krim tartar, berkembang secara semula jadi dalam proses penapaian. Ia biasanya dicampur dengan natrium bikarbonat dan dijual sebagai serbuk penaik yang digunakan sebagai agen penaik dalam penyediaan makanan. Asid itu sendiri ditambah kepada makanan sebagai antioksidan dengan kod E334 untuk memberikan rasa masam yang tersendiri. Asid tartarik semulajadi adalah bahan mentah yang berguna dalam sintesis kimia organik. Asid tartarik, asid alfa-hidroksi-karboksilik, adalah diprotik dan aldarik dalam ciri-ciri asid, dan merupakan terbitan dihidroksil asid suksinik.
| |
 Ball-and-stick model of L-(+)-tartaric acid
| |
| Nama | |
|---|---|
| Nama IUPAC pilihan
2,3-Dihydroxybutanedioic acid | |
| Nama lain
Tartaric acid
2,3-Dihydroxysuccinic acid Threaric acid Racemic acid Uvic acid Paratartaric acid Winestone | |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.121.903 |
| Nombor E | E334 (pengantioksida & pengawal keasidan) |
| KEGG | |
| MeSH | tartaric+acid |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
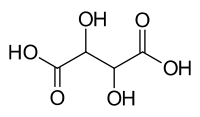
| C4H6O6 (basic formula) HO2CCH(OH)CH(OH)CO2H (structural formula) | |
| Jisim molar | 150.087 g/mol |
| Rupa bentuk | White powder |
| Ketumpatan | 1.737 g/cm3 (R,R- and S,S-) 1.79 g/cm3 (racemate) 1.886 g/cm3 (meso) |
| Takat lebur | 169, 172 °C (R,R- and S,S-) 206 °C (racemate) 165-6 °C (meso) |
| |
| Keasidan (pKa) | L(+) 25 °C : pKa1= 2.89, pKa2= 4.40 meso 25 °C: pKa1= 3.22, pKa2= 4.85 |
| Bes konjugat | Bitartrate |
| −67.5·10−6 cm3/mol | |
| Bahaya | |
| Piktogram GHS | 
|
| Perkataan isyarat GHS | Danger |
| Templat:HPhrases | |
| Templat:PPhrases | |
| Sebatian berkaitan | |
Kation lain
|
Monosodium tartrate Disodium tartrate Monopotassium tartrate Dipotassium tartrate |
carboxylic acids berkaitan
|
Butyric acid Succinic acid Dimercaptosuccinic acid Malic acid Maleic acid Fumaric acid |
Sebatian berkaitan
|
2,3-Butanediol Cichoric acid |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Sejarah sunting
Asid tartarik telah diketahui oleh pembuat wain untuk beberapa abad. Walau bagaimanapun, proses kimia untuk pengekstrakan hanya dibangunkan dan dicatatkan pada tahun 1769 oleh ahli kimia Sweden Carl Wilhelm Scheele.[4]
Asid tartarik memainkan peranan penting dalam penemuan kiraliti kimia. Sifat asid tartarik ini pertama kali diperhatikan pada tahun 1832 oleh Jean Baptiste Biot, yang memerhatikan keupayaannya untuk memutarkan cahaya terkutub.[5][6] Louis Pasteur meneruskan penyelidikan ini pada tahun 1847 dengan menyiasat bentuk kristal natrium ammonium tartrat, yang didapatinya sebagai struktur kiral. Dengan mengisih secara manual kristal berbentuk berbeza, Pasteur adalah yang pertama menghasilkan sampel tulen asid levotartarik.[7][8][9][10][11]
Stereokimia sunting
Bentuk asid yang wujud secara semula jadi ialah bentuk dekstro-tartarik atau L-(+)-tartarik (nama dahulu asid d-tartarik). Kerana ia boleh didapati secara semula jadi, ia lebih murah daripada enantiomer dan isomer meso. Awalan dekstro dan levo adalah istilah purba.[12] Buku teks moden merujuk kepada bentuk semula jadi sebagai (2R ,3R)-asid tartarik (asid L-(+)-tartarik), dan enantiomernya sebagai asid (2S ,3S)-tartarik ( asid D-(-)-tartarik). Diastereomer meso dirujuk sebagai asid (2R,3S)-tartarik atau (2S,3R)-tartarik.
- Dekstro dan levo membentuk hablur sfenoid monoklin[13] dan hablur ortorombus.
- Asid tartarik rasemik membentuk kristal monoklin[14] dan triklin (kumpulan ruang P1 ).[15][16]
- Asid meso-tartarik kontang membentuk dua polimorf kontang: triklin dan ortorombus.
- Asid tartarik meso terhidrat menghablur sebagai polimorf monoklin dan triklin, bergantung pada suhu di mana penghabluran daripada larutan akueus berlaku.[17]
Asid tartarik dalam larutan Fehling mengikat ion kuprum(II), dan ini menghalang pembentukan garam hidroksida yang tidak larut.
| DL-asid tartarik (asid rasemik)
(nisbah 1:1) |
asid mesotartarik | |
|---|---|---|
| asid dekstrotartarik (L-(+)-asid tartarik) |
asid levotartarik (D-(−)-asid tartarik) | |
| Nama lazim | Asid tartarik | Asid levotarik | Asid dekstrotartarik | Asid mesotartarik | Asid rasemik |
|---|---|---|---|---|---|
| sinonim | asid (2S,3S)-tartarik asid (S,S)-tartarik asid (−)-tartarik asid l-tartarik (nama lapuk) asid levotartarik asid D-tartarik asid D-trearik ("isomer tidak semula jadi")[18] |
asid (2R,3R)-tartarik asid (R,R)-tartarik asid (+)-tartarik asid d-tartarik (nama lapuk) asid L-tartarik asid L-trearik ("isomer semula jadi")[19] |
asid (2R,3S)-tartarik asid meso-tartarik asid eritrarik |
asid rac-(2R,3S)-tartarik asid (2RS,3SR)-tartarik asid (±)-tartarik asid DL-tartarik asid dl-tartarik (usang) asid paratartarik asid uvik | |
| PubChem | CID 875 daripada PubChem | CID 439655 daripada PubChem | CID 444305 daripada PubChem | CID 78956 daripada PubChem | CID 5851 daripada PubChem |
| Nombor EINECS | 205-695-6 | 201-766-0 | 205-696-1 | 205-105-7 | |
| nombor CAS | 526-83-0 | 147-71-7 | 87-69-4 | 147-73-9 | 133-37-9 |
Penghasilan sunting
Asid L-(+)-tartarik sunting
Isomer asid L-(+)-tartarik dihasilkan secara industri dalam jumlah terbesar. Ia diperoleh daripada lintah, hasil sampingan pepejal penapaian. Bekas hasil sampingan kebanyakannya terdiri daripada kalium bitartrat (KHC4H4O6). Garam kalium ini ditukar kepada kalsium tartrat (CaC4H4O6) apabila dirawat dengan kalsium hidroksida yang juga digelar "susu kapur" (Ca(OH)2):
Secara praktikal, hasil kalsium tartrat yang lebih tinggi diperolehi dengan penambahan kalsium klorida. Kalsium tartrat kemudiannya ditukar kepada asid tartarik dengan merawat garam dengan asid sulfurik akueus:
Asid tartarik rasemik sunting
Asid tartarik bentuk rasemik boleh dihasilkan dalam tindak balas berbilang langkah daripada asid maleik. Pada langkah pertama, asid maleik diepoksidakan oleh hidrogen peroksida menggunakan kalium tungstat sebagai pemangkin.
- HO2CC2H2CO2H + H2O2 → OC2H2(CO2H)2
Dalam langkah seterusnya, epoksida dihidrolisiskan.
- OC2H2(CO2H)2 + H2O → (HOCH)2(CO2H)2
Asid meso-tartarik sunting
Campuran asid rasemik dan asid meso-tartarik terbentuk apabila bentuk dekstro-tartarik dipanaskan dalam air pada suhu 165 °C selama kira-kira 2 hari. meso-Asid tartarik juga boleh disediakan daripada asid dibromosuccinic menggunakan perak hidroksida:[20]
- HO2CCHBrCHBrCO2H + 2 AgOH → HO2CCH(OH)CH(OH)CO2H + 2 AgBr
Asid meso-tartarik boleh diasingkan daripada sisa asid rasemik melalui penghabluran, bentuk rasemat yang kurang larut.
Kereaktifan sunting
Asid L-(+)-tartarik boleh mengambil bahagian dalam beberapa tindak balas. Seperti yang ditunjukkan skema tindak balas di bawah, asid dihidroksimaleik terhasil apabila rawatan asid L-(+)-tartarik dengan hidrogen peroksida dengan kehadiran garam ferus sebagai pemangkin.
- HO2CCH(OH)CH(OH)CO2H + H2O2 → HO2CC(OH)C(OH)CO2H + 2 H2O
Asid dihidroksimaleik kemudiannya boleh dioksidakan kepada asid tartronik dengan asid nitrik.[21]
Terbitan sunting
Derivatif penting asid tartarik termasuk garamnya, krim tartar (kalium bitartrat), garam Rochelle (kalium natrium tartrat, sebuah bahan julap yang ringan kesannya), dan tartar emetik (antimoni kalium tartrat).[22][23][24] Diisopropil tartrat digunakan sebagai pemangkin bersama dalam sintesis asimetri.
Asid tartarik ialah toksin otot yang berfungsi dengan menghalang pengeluaran asid malik, dan dalam dos yang tinggi, boleh menyebabkan lumpuh dan kematian.[25] Dos median maut (LD50) ialah kira-kira 7.5 gram/kg bagi manusia, 5.3 gram/kg untuk arnab, dan 4.4 gram/kg untuk tikus. [26] Memandangkan angka ini, ia akan mengambil masa lebih 500 g (18 oz) untuk membunuh orang seberat 70 kg (150 lb) dengan kebarangkalian 50%, jadi ia boleh dimasukkan dengan selamat dalam banyak makanan, terutamanya gula-gula yang rasa masam. Sebagai bahan tambahan makanan, asid tartarik digunakan sebagai antioksidan dengan nombor E E334; tartrat ialah bahan tambahan lain yang berfungsi sebagai antioksidan atau pengemulsi.
Apabila krim tartar ditambah kepada air, penggantungan akan terhasil dalam air tersebut dan lapisan ini boleh berfungsi untuk membersihkan syiling kuprum dengan baik, kerana larutan tartrat boleh melarutkan lapisan kuprum(II) oksida yang terdapat pada permukaan syiling. Kompleks kuprum(II)-tartrat yang terhasil mudah larut dalam air.
Asid tartarik dalam wain sunting
Asid tartarik mungkin paling mudah dikenali oleh peminum wain sebagai sumber "berlian wain", kristal kalium bitartrat kecil yang kadangkala terbentuk secara spontan pada gabus atau bahagian bawah botol. "Tartrat" ini tidak berbahaya, walaupun kadangkala disalah anggap sebagai kaca pecah, dan dihalang pembentukannya dalam banyak wain melalui penstabilan sejuk (yang tidak selalu diutamakan kerana ia boleh mengubah profil wain). Tartrat yang tinggal di bahagian dalam tong yang sudah tua pada satu masa dahulu merupakan sumber industri utama untuk kalium bitartrat.
Asid tartarik memainkan peranan penting secara kimia, menurunkan pH penapaian yang "wajib" ke tahap di mana banyak bakteria rosak yang tidak diingini tidak boleh hidup, dan bertindak sebagai pengawet selepas penapaian. Di dalam mulut, asid tartarik memberikan sedikit rasa asam dalam wain, walaupun asid sitrik dan malik juga memainkan peranan dalam rasa asam tersebut.
Asid tartarik dalam sitrus sunting
Hasil daripada kajian menunjukkan bahawa dalam sitrus, buah-buahan yang dihasilkan dalam pertanian organik mengandungi tahap asid tartarik yang lebih tinggi daripada buah-buahan yang dihasilkan dalam tanaman pertanian konvensional. [27]
Aplikasi sunting
Asid tartarik dan derivatifnya mempunyai banyak kegunaan dalam bidang farmaseutikal. Sebagai contoh, ia telah digunakan dalam pengeluaran garam pembuih, dalam kombinasi dengan asid sitrik, untuk meningkatkan rasa ubat oral.[21] Derivatif kalium antimonil asid yang dikenali sebagai tartar emetic dimasukkan, dalam dos yang kecil, dalam sirap batuk sebagai ekspektoran (bahan membuang kahak).
Asid tartarik juga mempunyai beberapa aplikasi untuk kegunaan industri. Asid telah diperhatikan untuk mengelat ion logam seperti kalsium dan magnesium. Oleh itu, asid telah berkhidmat dalam industri perladangan dan logam sebagai agen pengkelat untuk kompleks mikronutrien dalam baja tanah dan untuk membersihkan permukaan logam yang masing-masing terdiri daripada aluminium, kuprum, besi, dan aloi logam ini.
Ketoksikan dalam anjing sunting
Walaupun asid tartarik boleh diterima dengan baik oleh manusia dan haiwan makmal, sebuah surat bertarikh April 2021 kepada editor JAVMA membuat hipotesis bahawa asid tartarik dalam anggur boleh menjadi punca ketoksikan anggur dan kismis pada anjing.[28]
Rujukan sunting
- ^ Tartaric Acid – Compound Summary, PubChem.
- ^ Dawson, R.M.C. et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ Duarte, A.M.; Caixeirinho, D.; Miguel, M.G.; Sustelo, V.; Nunes, C.; Fernandes, M.M.; Marreiros, A. (2012). "Organic acids concentration in citrus juice from conventional versus organic farming". Acta Horticulturae. 933 (933): 601–606. doi:10.17660/actahortic.2012.933.78. ISSN 0567-7572. Diarkibkan daripada yang asal pada 2018-06-02. Dicapai pada 2018-05-05.
|hdl-access=requires|hdl=(bantuan) - ^ Retzius, Anders Jahan (1770) "Försök med vinsten och dess syra" (Experiments with cream of tartar and its acid), Kungliga Vetenskapsakademiens Handlingar (Proceedings of the Royal Academy of Sciences), 31 : 207–213. From p. 209: "§. 6. Dessa försök omtalte jag för Hr. Carl Wilhelm Scheele (en snabb och lårgirug Pharmaciæ Studiosus) … " (§. 6. I mention these experiments on behalf of Mr. Carl Wilhelm Scheele (a quick and studious student of pharmacology) … )
- ^ Biot (1835) "Mémoire sur la polarization circulaire et sur ses applications à la chimie organique" (Memoir on circular polarization and on its applications to organic chemistry), Mémoires de l'Académie des sciences de l'Institut, 2nd series, 13 : 39–175. That tartaric acid (acide tartarique cristallisé) rotates plane-polarized light is shown in Table G following p. 168. (Note: This article was read to the French Royal Academy of Sciences on 1832 November 5.)
- ^ Biot (1838) "Pour discerner les mélanges et les combinaisons chimiques définies ou non définies, qui agissent sur la lumière polarisée; suivies d'applications aux combinaisons de l'acide tartarique avec l'eau, l'alcool et l'esprit de bois" (In order to discern mixtures and chemical combinations, defined or undefined, which act on polarized light; followed by applications to combinations of tartaric acid with water, alcohol [i.e., ethanol], and spirit of wood [i.e., methanol]), Mémoires de l'Académie des sciences de l'Institut, 2nd series, 15 : 93–279.
- ^ L. Pasteur (1848) "Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire" (Memoir on the relationship which can exist between crystalline form and chemical composition, and on the cause of rotary polarization)," Comptes rendus de l'Académie des sciences (Paris), 26 : 535–538.
- ^ L. Pasteur (1848) "Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire" (On the relations that can exist between crystalline form, and chemical composition, and the sense of rotary polarization), Annales de Chimie et de Physique, 3rd series, 24 : 442–459.
- ^ Pasteur, Louis (1850) "Recherches sur les propriétés spécifiques des deux acides qui composent l'acide racémique" [Investigations into the specific properties of the two acids that compose racemic acid], Annales de Chimie et de Physique, 3rd series, 28 (3) : 56–99. See also Plate II. (See also the report of the commission that was appointed to verify Pasteur's findings, pp. 99–117.) [in French]
- ^ George B. Kauffman; Robin D. Myers (1998). "Pasteur's resolution of racemic acid: A sesquicentennial retrospect and a new translation" (PDF). The Chemical Educator. 3 (6): 1–4. doi:10.1007/s00897980257a. Diarkibkan daripada yang asal (PDF) pada 2006-01-17.
- ^ Flack, H.D. (2009). "Louis Pasteur's discovery of molecular chirality and spontaneous resolution in 1848, together with a complete review of his crystallographic and chemical work" (PDF). Acta Crystallographica A. 65 (5): 371–389. Bibcode:2009AcCrA..65..371F. doi:10.1107/S0108767309024088. PMID 19687573. Diarkibkan daripada yang asal (PDF) pada 2012-09-06.
- ^ "Lecture 28: Stereochemical Nomenclature; Racemization and Resolution | CosmoLearning Chemistry". CosmoLearning.
- ^ W, T, Astbury (Feb 1923). "The Crystalline Structure and Properties of Tartaric Acid". Proc. R. Soc. A. 102 (718): 506–528. Bibcode:1923RSPSA.102..506A. doi:10.1098/rspa.1923.0010.CS1 maint: multiple names: authors list (link), based on P. Groth’s “Chemische Krystallographie".
- ^ CRC Handbook of Chemistry and Physics, 49th edition.
- ^ Samantha Callear and Michael Hursthouse (2008). "D-Tartaric acid". Crystallography Open Database.
- ^ Paul Luner (Jul 2002). "(+-)-Tartaric acid". Acta Crystallographica Section C. 58 (6): o333–o335. doi:10.1107/S0108270102006650. PMID 12050433. Unknown parameter
|displayauthors=ignored (bantuan), "(±)-Tartaric acid". Crystallography Open Database. 2002. - ^ G. A. Bootsma and J. C. Schoone (1967). "Crystal Structures of Meso Tartaric Acid". Acta Crystallogr. 22 (4): 522–532. doi:10.1107/S0365110X67001070.
- ^ "d-Tartaric acid". PubChem.
- ^ "L-(+)-Tartaric acid". PubChem. Diarkibkan daripada yang asal pada May 16, 2015.
- ^ Augustus Price West. Experimental Organic Chemistry. World Book Company: New York, 1920, 232-237.
- ^ a b "Hydroxy Dicarboxylic Acids". Kirk Othmer Encyclopedia of Chemical Technology. 2000. m/s. 1–19. doi:10.1002/0471238961.0825041802120109.a01. ISBN 0471238961. Ralat petik: Tag
<ref>tidak sah, nama "Blair" digunakan secara berulang dengan kandungan yang berbeza - ^ Zalkin, Allan; Templeton, David H.; Ueki, Tatzuo (1973). "Crystal structure of l-tris(1,10-phenathroline)iron(II) bis(antimony(III) d-tartrate) octahydrate". Inorganic Chemistry. 12 (7): 1641–1646. doi:10.1021/ic50125a033.
- ^ Haq, I; Khan, C (1982). "Hazards of a traditional eye-cosmetic--SURMA". The Journal of the Pakistan Medical Association. 32 (1): 7–8. PMID 6804665.
- ^ McCallum, RI (1977). "President's address. Observations upon antimony". Proceedings of the Royal Society of Medicine. 70 (11): 756–63. doi:10.1177/003591577707001103. PMC 1543508. PMID 341167.
- ^ Alfred Swaine Taylor, Edward Hartshorne (1861). Medical jurisprudence. Blanchard and Lea. m/s. 61.
- ^ Joseph A. Maga, Anthony T. Tu (1995). Food additive toxicology. CRC Press. m/s. 137–138. ISBN 0-8247-9245-9.
- ^ Duarte, A.M.; Caixeirinho, D.; Miguel, M.G.; Sustelo, V.; Nunes, C.; Fernandes, M.M.; Marreiros, A. (2012). "Organic Acids Concentration in Citrus Juice from Conventional Versus Organic Farming". Acta Horticulturae. 933 (933): 601–606. doi:10.17660/actahortic.2012.933.78. ISSN 0567-7572.
|hdl-access=requires|hdl=(bantuan) - ^ McReynolds, Tony (April 1, 2021). "What causes grape toxicity in dogs? Playdough might have led to a breakthrough". American Animal Hospital Association.
Pautan luar sunting
- Fail PDB untuk MSE Diarkibkan 2018-09-20 di Wayback Machine </link>