Glukosa
Glukosa ialah sejenis gula ringkas dengan formula molekul C6H12O6. Ia merupakan salah satu monomer bagi karbohidrat. Glukosa adalah monosakarida yang paling banyak terdapat secara semulajadinya.
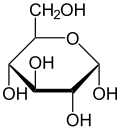 Unjuran Haworth α-d-glukopiranosa
| |
 Unjuran Fischer d-glukosa
| |
| Nama | |
|---|---|
Nama IUPAC
| |
| Nama IUPAC pilihan
PIN tidak ditetapkan bagi bahan semula jadi. | |
Nama lain
| |
| Pengecam | |
Imej model 3D Jmol
|
|
| 3DMet | |
| Singkatan | Glc |
| 1281604 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nombor EC |
|
| 83256 | |
| KEGG | |
| MeSH | Glucose |
PubChem CID
|
|
| Nombor RTECS |
|
| UNII |
|
| |
| |
| Sifat | |
| C6H12O6 | |
| Jisim molar | 180.16 g/mol |
| Rupa bentuk | Serbuk putih |
| Ketumpatan | 1.54 g/cm3 |
| Takat lebur | α-d-Glukosa: 146 °C (295 °F; 419 K) β-d-Glukosa: 150 °C (302 °F; 423 K) |
| 909 g/L (25 °C (77 °F)) | |
| −101.5×10−6 cm3/mol | |
| Momen dwikutub | 8.6827 |
| Termokimia | |
| Muatan haba tentu, C | 218.6 J/(K·mol)[1] |
| Entropi molar piawai S |
209.2 J/(K·mol)[1] |
Entalpi pembentukan
piawai (ΔfH⦵298) |
−1271 kJ/mol[2] |
| 2,805 kJ/mol (670 kcal/mol) | |
| Farmakologi | |
| Kod ATC | B05CX01 V04, V06 |
| Bahaya | |
| MSDS | ICSC 08655 |
| NFPA 704 (berlian api) | |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Terdapat dua jenis glukosa iaitu D-glukosa dan L-glukosa yang dibezakan oleh konfigurasi pada atom karbon kelima. Glukosa kemudiannya dapat disusun strukturnya dari satu rantai memanjang ("unjuran Fischer") kepada satu struktur siklik ("unjuran Haworth") seperti yang ditunjukkan dalam rajah di sebelah.

Nama "glukosa" ini diambil melalui bahasa Perancis ("glucose") daripada istilah akar bahasa Yunani iaitu γλυκός, "manis" yang merujuk kepada bahan mentah asal bahan ini iaitu pemerasan anggur pertama yang dihasilkan dalam pembuatan wain.[3] Ia pertama kalinya diasingkan sebagai bahan sendirinya oleh Andreas Sigismund Marggraf, seorang saintis Jerman, pada tahun 1747.[4]
Sumber dan penghasilan
suntingBiosintesis
suntingDalam tumbuh-tumbuhan dan sesetengah prokariot, glukosa merupakan hasil proses fotosintesis. Ia juga dihasilkan (terutamanya dalam haiwan dan kulat) daripada peruraian bentuk-bentuk glukosa yang berpolimer—glikogen (haiwan, kulat) atau kanji (bijirin seperti beras, jagung, barli dan sebagainya); pembelahan glikogen dirujuk sebagai glikogenolisis,[perlu rujukan] kanji, atau peruraian kanji.[5] Dalam haiwan pula, glukosa disintesiskan dalam hati dan buah pinggang daripada bahan perantara bukan karbohidrat seperti piruvat, laktat dan gliserol melalui proses glukoneogenesis.[perlu rujukan] Dalam sesetengah spesies bakteria dasar laut, glukosa dihasilkan melalui kemosintesis.[perlu rujukan]
Komersial
suntingGlukosa dihasilkan secara komersialnya melalui hidrolisis kanji berpemangkin enzim. Pelbagai jenis tanaman boleh digunakan sebagai sumber kanji di mana jagung, beras, gandum, ubi kayu, hampas jagung dan sagu digunakan di pelbagai tempat di seluruh dunia. Kebanyakan glukosa komersial wujud dalam bentuk komponen gula songsang (invert sugar) iaitu campuran kasar glukosa dan fruktosa bernisbah 1:1. Pokoknya, selulosa boleh dihidrolisiskan menjadi glukosa, namun proses ini belum lagi boleh dipergunakan secara komersialnya.[6] Sirap glukosa (juga dikenali sebagai sirap jagung) secara asasnya merupakan larutan akueus sakarida tulen dihasilkan daripada kanji boleh dimakan, yang mempunyai nilai kesetaraan dekstrosa (dextrose equivalency, DE) sebanyak 20 atau lebih; sirap jagung yang dikeringkan adalah sirap glukosa yang dikeluarkan airnya. Glukosa mempunyai nilai DE sebanyak 100 manakala maltodekstrin kering mempunyai nilai DE kurang daripada 20. Sirap jagung dengan sendirinya mempunyai nilai DE antara 20 dan 95.[7]
Ciri fizikal
suntingLarutan
suntingKesemua jenis bentuk glukosa diperhatikan tidak berwarna dan mudah larut dalam air, asid asetik dan beberapa larutan yang lain. Jenis-jenis glukosa ini sedikit larut dalam metanol dan etanol.
Bentuk pepejal
suntingTiga bentuk pepejal glukosa dapat dihablurkan daripada larutan air bergantung kepada keadaan persekitaran, iaitu α-glukopiranosa, β-glukopiranosa, dan β-glukopiranosa hidrat.[6]
Dalam biologi manusia
suntingJumlah glukosa yang diperlukan oleh tubuh setiap hari ialah 160g. 120g daripadanya diperlukan oleh otak setiap hari bagi orang dewasa. Jumlah glukosa yang terdapat dalam cecair tubuh ialah 20g dan yang sedia ada daripada penguraian glikogen simpanan ialah 190g. Justeru, glikogen simpanan dapat membekalkan glukosa kepada tubuh secara mencukupi untuk tempoh satu hari sahaja. Dalam keadaan kebuluran yang berpanjangan, glukosa mesti dibentukkan daripada sumber bukan karbohidrat.
Rujukan
sunting- ^ a b Boerio-Goates, Juliana (1991), "Heat-capacity measurements and thermodynamic functions of crystalline α-D-glucose at temperatures from 10K to 340K", J. Chem. Thermodyn., 23 (5): 403–09, doi:10.1016/S0021-9614(05)80128-4
- ^ Ponomarev, V. V.; Migarskaya, L. B. (1960), "Heats of combustion of some amino-acids", Russ. J. Phys. Chem. (Engl. Transl.), 34: 1182–83
- ^ "Online Etymology Dictionary". Etymonline.com. Dicapai pada 25 November 2016.
- ^ Encyclopedia of Food and Health (dalam bahasa Inggeris). Academic Press. 2015. m/s. 239. ISBN 9780123849533.
- ^ Smith, Alison M.; Zeeman, Samuel C.; Smith, Steven M. (2005). "Starch Degradation". Annu. Rev. Plant Biol. 56: 73–98. doi:10.1146/annurev.arplant.56.032604.144257.
- ^ a b Fred W. Schenck "Glucose and Glucose-Containing Syrups" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a12_457.pub2 10.1002/14356007.a12_457.pub2
- ^ Starch: Chemistry and Technology. Food Science and Technology (ed. 3rd). New York: Academic Press. 2009. ISBN 008092655X. Dicapai pada 25 November 2016. Unknown parameter
|editors=ignored (bantuan)
Pautan luar
sunting| Wikimedia Commons mempunyai media berkaitan Glukosa |
- "Glucose". Drug Information Portal. U.S. National Library of Medicine.
- "Dextrose mixture with sodium chloride". Drug Information Portal. U.S. National Library of Medicine.
